- Учителю
- План-конспект по химии на тему Алканы 10 класс
План-конспект по химии на тему Алканы 10 класс
План-конспект «Алканы. Строение. Номенклатура. Физические свойства. Получение. Химические свойства. Применение»
-
Класс 10
1.2. Базовый учебник О.С. Габриелян
1.3. Глава 3 «Углеводороды»
1.4. § 11 « Алканы»
1.5. Для урока учащиеся должны знать такие темы как: природные источники углеводородов, типы химических реакций в органической химии, строение атома углерода.
Урок необходим для дальнейшего изучения следующих тем: - алкены, алкины, циклоалкапны, алкадиены, ароматические углеводороды..
1.6. 10 класс базовый уровень
2. Цель - формирование ключевых знаний у учащихся об изомерии, гомологии, строении, свойствах, способах получения, применения алканов.
Задачи:
-
Образовательные - рассмотреть гомологический ряд предельных углеводородов, строение, физические и химические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля, области применения алканов.
-
Развивающие - развивать умение выдвигать гипотезу и проверять её, умение наблюдать и рассуждать, классифицировать и анализировать, делать выводы, способность к рефлексии и саморефлексии,
-
Воспитывающие - воспитание самостоятельности, ответственности, активной жизненной позиции; показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля.
-
Тип урока - изучение нового материала.
-
Оборудование и реактивы: Химия 10 класс: учеб. для общеобразоват. учреждений /О.С.Габриелян, Ф.Н. Маскаев, С.Ю.Пономарев, В. И. Теренин - М.: Дрофа, 2005.-300,[4]с.: ил., компьютер, проектор, презентация, шаростержневая система, портрет Семенова Н.Н., парафиновая свеча, керосиновая лампа, холодная и горячая вода, кристаллизаторы, спички, пинцет.
Ход урокаПриветствие учащихся, организация внимания.
Приветствие учителя.
Введение в тему
-
Зажигаем парафиновую свечу и керосиновую лампу.
-
Демонстрируем нерастворимость парафина и керосина в холодной воде.
-
Демонстрируем нерастворимость парафина и керосина в горячей воде, наблюдаем за каплями расплавленного парафина, стекающими по свече.
- Как вы думаете: почему парафин и керосин в горячей воде не растворим?
О чём сегодня пойдёт речь на уроке?
Сообщение темы урока: "Алканы"
Парафины - твёрдые предельные (насыщенных) углеводороды. Парафин не растворим в воде
О веществах, которые входят в состав парафина и керосина, а так же и о других похожих на них соединениях.
Актуализация знаний
Алканы относят к классу углеводородов.
- Вспомните, какие вещества называют углеводородами?
- Вспомните, чему равна валентность атомов углерода в органических соединениях?
- Чему равна валентность атомов водорода?
(Химический знак и валентность атомов углерода и водорода).
Электронное строение атома углерода, переход его в возбужденное состояние.
Углеводороды - соединения, состоящие только из атамов углерода и водорода.
Валентность атома С=IV
Валентность Н=I
С:1S22S22P2 →→→
C*:1S22S12P3
основное состояние→*возбужденное состояние.
Изучение нового материала
На доске написан план изучения алканов:
- строение
- гомологический ряд
- изомерия и номенклатура
- получение
- физические свойства
- химические свойства
- применение
1. Строение
Почему алканы называются «предельными или насыщенными углеводородами»?
АЛКАНЫ - это углеводороды с общей формулой Сп Н2п + 2 в молекулах которых между атомами углерода имеются только одинарные (сигма) связи.
В молекулах алканов имеются только одинарные - связи. Все четыре валентности атома углерода в молекулах алканов полностью, т.е. до предела, насыщены атомами углерода и водорода. Между атомами углерода отсутствуют кратные связи. Отсюда происходят другие названия этих углеводородов - насыщенные или предельные.
(Показ шаростержневую молекулу метана,и других алканов.)
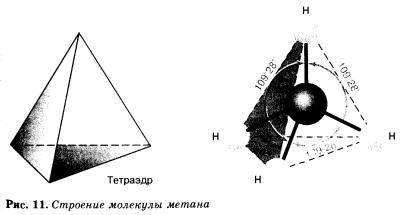
Алканы- sp3 гибридизация электронных орбиталей. Строение молекулы метана - тетраэдическое, углы между орбиталями равны 109°28'.
Гомологический ряд:
Что такое гомологи?
Гомологический ряд метана:
СН4-метан
С2H6-этан
C3H8-пропан
C4H10-бутан
C5H12-пентан
C6H14-гексан
C7H16-гептан
C8H18-октан
C9H20-нонан
C10H22-декан
Изомерия и номенклатура:
Для алканов характерна только изомерия углеродного скелета. Начиная с бутана у каждого алкана с линейной цепью появляется изомеры с разветвленным углеродным скелетом, возникла необходимость выработать систему их названий. Такая система была разработана Международным союзом теоретической и прикладной химии (ИЮПАК) и получила название международной номенклатуры ИЮПАК.
Алгоритм составления названия алканов.
1.В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь)
2.Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
3.В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов (два, три, четыре и т. д.) то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
4.Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что ив главной цепи.
Задание 1. Составления названия алканов.
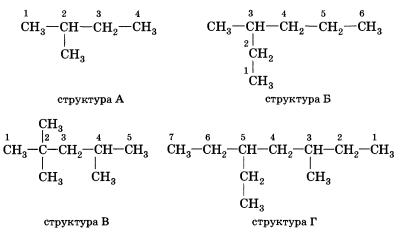 .
.
Физические свойства:
СН4-C4Н10 - газы
T кипения: -161,6; -0,5 °C
T плавления: -182,5; - 138,3 °C
С5Н12-C15Н32 - жидкости
T кипения: 36,1-270,5 °C
T плавления: -129,8 - 10 °C
С16Н34 и далее - твёрдые вещества
T кипения: 287,5 °C
T плавления: 20 °C
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
Получение:
Каким способом можно получить алканы?
Класс делится на группы. 1 группа работает с учебником на стр. 70-71,
2 группа - на стр. 71-72. Вопросы: 1 гр.- промышленный способ получения алканов, 2 группа - лабораторный способ получения алканов.
Химические свойства
Для алканов характерны следующие типы химических реакций:
-
замещение атомов водорода;
-
дегидрирование;
-
крекинг;
-
окисление
1) Замещение атомов водорода:
А) реакция галогенирования:
CH4 +Cl2 → CH3Cl + HCl
Доклад учащихся о Семенове Н. Н.
Б) реакция нитрования (Коновалова):
.C4H10+HONO2--->C4H9NO2+H2O.
В) реакция сульфирования:
CH4 + H2SO4 → CH3-SO3 H + H2O + Q
3) Реакция с водяным паром:
CH4 + H2O→ CO + 3H2
4) Реакция дегидрирования:
2СН4 → НС=СН + 3Н2 + Q
5) Реакция окисления:
CH4 + 2O2 → Н-C + 2H2O + Q
6) Горение метана:
CH4 + 2O2 → CO2 + 2H2O + Q
Применение:
(заранее подготовленные выступления учащихся.)
Выдвигают свои предположения
Записывают определение в тетради
Записывают и зарисовывают в тетради.
Гомологи - это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп -СH2
Записывают в тетради
А) 2-метилбутан
Б) З-метилгексан
В) 2,2,4 - триметилпентап
Г) З-метил - 5 - этилтептан
Записывают в тетради
В промышленности:
1) крекинг нефтепродуктов:
C16H34 → C8H18 + C8H16
2) В лаборатории:
а) гидролиз карбидов:
Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3
б) реакция Вюрца:
C2H5Cl + 2Na → C4H10 + 2NaCl
в)декарбоксилирование натриевых солей карбоновых солей:
СН3СООNa + 2NaОН → СН4 + Nа2СО3
Широко используются в качестве топлива, в том числе для
двигателей внутреннего сгорания, а также при производстве сажи
(1 - картриджи; 2 - резина; 3 - типографская краска), при получение органических веществ (4 - растворителей; 5 - хладогентов, используемых в холодильных установках; 6 - метанол; 7 - ацетилен)
Закрепление изученного материала
III. Закрепление: индивидуальная работа у доски и в тетрадях
- Составьте все возможные изомеры гептана и назовите их.
- Составьте два ближайших гомолога пентана и назовите их.
- Определите предельный углеводород, плотность паров по воздуху которого равна 2. (C4H10)
Рефлексия
«Лестница успеха»
Умею…
Понимаю…
Знаю….
Оценивают свою деятельность
Домашнее задание
§11, упр. 4, 5,7, 8 (стр. 81). Подготовка к самостоятельной работе
Сообщение из истории получения этилена - 1 (ч-к)
Записывают Д/З