- Учителю
- Конспект урока для 8 класса по химии 'Моль. Количества вещества. '
Конспект урока для 8 класса по химии 'Моль. Количества вещества. '
Химия 8 класс МБОУ СОШ №64
Учитель: Каленова Светлана Вячеславовна
Тема урока: Количество вещества. Моль.
Дата:
Содержание
Деятельность учителя
Деятельность учащихся
I. Мотивационный этап.
1.Организационный этап.
2. Мотивация.
3. Ключевое слово.
4. Проблема.
5. Цель.
6. Задачи.
7. Гипотеза.
II.Операционный этап.
1.Ход исследования.
2. Оценка.
III. Аналитический этап.
-
Инверсия
-
Домашнее задание.
-
Выставление отметок.
Приветствие учащихся (выявление отсутствующих).
Знакомит с темой урока и записывает на доске: «Количество вещества. Моль.»
Задает вопросы.
Какая наука изучает вещества, их свойства, превращения веществ и явления, сопровождающие эти превращения?
Какие единицы измерения веществ существуют?
В чем вы уже умеете измерять вещество?
Можно ли определить массу нескольких молекул на практике?
А можно ли сосчитать число молекул?
Сахар - это вещество. Сколько ложек сахарного песка вы кладете в чашку чая? Рассчитайте:
1). Какое количество сахарозы вы выпиваете с чаем?
2). Сколько молекул сахарозы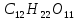 содержится в этом количестве, если в 1 чайной ложке примерно 5г сахарозы?
содержится в этом количестве, если в 1 чайной ложке примерно 5г сахарозы?
Для измерения вещества была выбрана особая единица, в которой как бы соединились - число молекул и масса вещества. Это единица количества вещества была названа - моль.
Нужна ли физическая величина, которая позволит перевести количество структурных единиц вещества в его массу?
Как я могу измерить число структурных единиц вещества и определить количество вещества?
Изучить понятие моль.
а) интерпретация понятия о количестве вещества и единицах его измерения: моль, ммоль, кмоль;
б) реконструкция представления о постоянной Авогадро; показать взаимосвязь массы, количества вещества и числа частиц;
Предлагает учащимся гипотезу найти в тексте §17с.42.
Знакомит учащихся с последовательностью исследования.
Вопросы и задания на доске (экране).
1). Специальная величина количества вещества и ее обозначение.
2). Единица количества вещества - моль. Определение. Количество частиц в 1 моле вещества.
Задание: используя полученную информацию, ответьте на вопросы:
а) сколько атомов кислорода содержится в 1 моле кислорода;
б) сколько атомов водорода и кислорода содержится в 1 моле воды.
3). Объяснить понятие постоянная Авогадро. Ее обозначение, численное значение и размерность величины.
Формула, связывающая число молекул, постоянную Авогадро и количество вещества.
Задача №1.
Сколько атомов содержится в 2 молях серы?
Задача №2.
Сколько атомов содержится в 0,5 молях железа?
Задача №3.
Сколько молекул содержится в 5 молях углекислого газа?
Задача№4.
Какое количество вещества составляет 12*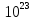 молекул этого вещества?
молекул этого вещества?
Задача №5.
Какое количество вещества составляет 0,6*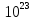 молекул этого вещества?
молекул этого вещества?
Задача №6.
Какое количество вещества составляет 3*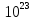 молекул этого вещества?
молекул этого вещества?
5). Для чего используют понятие молярная масса вещества. Определение, обозначение, размерность. Чему численно равна молярная масса вещества? Формулы для вычисления.
Задача №7.
Определить массу 0,5 моль железа?
Задача №8.
Определить массу 0,25 моль меди?
Задача №9.
Определить массу 2 моль углекислого газа?
Задача №10.
Сколько молей оксида меди составляет 160 г CuO?
Задача №11.
Сколько молей воды соответствуют 30г воды?
Задача №12.
Сколько молей магния соответствует его 40г?
Пользуясь планом, вопросами
записями в рабочей тетради
понятия темы ( моль, молярная
устанавливают взаимосвязь
молярная масса, постоянная
Совместно с учителем
заданий и решение задач.
Решили проблему, достигли
интерпретацию и реконструк
Возвращает к теме урока, ключевому слову, проблеме, к цели урока, его задачам и гипотезе.
§17 (с.41-44) упр.9 с.47
Выставляет отметки по критериям.
Приветствие учителя.
Отвечают на вопросы учителя, используя предыдущий
материал.
Выявляют дефицит знаний учащихся для формулирования проблемы урока.
Определяют вместе с учителем ключевое слово (моль).
Совместно с учителем формулируют проблему (или самостоятельно).
Самостоятельно формулируют цель.
Самостоятельно формулируют задачи.
Формулируют гипотезу с помощью учебника §17с.42:
Моль - это количество вещества, которое содержит столько структурных частиц (атомов, молекул), сколько атомов содержится в 12 г углерода.
Или самостоятельно формулируют второй вариант гипотезы:
Моль - число частиц вещества равное числу атомов в 12 г углерода.
Знакомятся с ходом исследования.
Самостоятельно работают с текстом учебника §17 с.42-44 по вопросам и записывают в рабочую тетрадь. В рабочих тетрадях решают задачи совместно с учителем.
Задания уровня А на воспроизведение знаний.
Решают задачи совместно с учителем (учитель знакомит учащихся с правилами оформления задач в рабочей тетради).
(на доске), текстом учебника и
воспроизводят основные
масса, постоянная Авогадро);
между понятиями (моль,
Авогадро, количество вещ-ва.
проверяют выполнение
цели. С помощью задач на
цию подтвердили гипотезу.
Рассмотрели основные понятия, установили взаимосвязь между величинами, применили знания для выполнения простейших задач на вычисление количества вещества по известной массе вещества и массы вещества по известному количеству вещества.
Записывают домашнее задание.
I. Мотивационный этап.
1.Организационный этап.
2. Мотивация.
3. Ключевое слово.
4. Проблема.
5. Цель.
6. Задачи.
7. Гипотеза.
II.Операционный этап.
1.Ход исследования.
2.Оценка.
III. Аналитический этап.
-
Инверсия
-
Домашнее задание.
-
Выставление отметок
Приветствие учащихся (выявление отсутствующих).
Задает вопросы.
Что изучает химия?
Из чего состоят вещества?
Что происходит с веществом при превращении или подвергнется ему?
В чем можно измерять вещества?
В чем вы уже умеете измерять вещество?
Можно ли определить массу нескольких молекул на практике?
А можно ли отсчитать число молекул?
Для измерения вещества была выбрана особая единица, в которой как бы соединились - число молекул и масса вещества. Это единица количества вещества была названа - моль.
Задает вопрос: Удобно ли пользоваться на практике столь малыми величинами как масса атома или молекулы?
Дать понятие о количестве вещества, единице его измерения - моль, ввести понятия: молярная масса, постоянная Авогадро.
Научить учащихся пользоваться этими понятиями для решения задач.
а) ввести понятие о количестве вещества и единицах его измерения: моль, ммоль, кмоль;
б) дать представление о постоянной Авогадро;
в) показать взаимосвязь массы. Количества вещества и числа частиц;
г) научить решать задачи.
Моль - число частиц вещества равное числу атомов в 12 г углерода.
Моль - это количество вещества, которое содержит столько структурных частиц (атомов, молекул), сколько атомов содержится в 12 г углерода.
Вопросы и задания на доске (экране).
1). Специальная величина количества вещества и ее обозначение.
2). Единица количества вещества - моль. Определение. Количество частиц в 1 моле вещества.
Задание: используя полученную информацию, ответьте на вопросы:
а) сколько атомов кислорода содержится в 1 моле кислорода;
б) сколько атомов водорода и кислорода содержится в 1 моле воды.
3). Объяснить понятие постоянная Авогадро. Ее обозначение, численное значение и размерность величины.
Формула, связывающая число молекул, постоянную Авогадро и количество вещества.
Задача №1.
Сколько атомов содержится в 2 молях серы?
Задача №2.
Сколько атомов содержится в 0,5 молях железа?
Задача №3.
Сколько молекул содержится в 5 молях углекислого газа?
Задача№4.
Какое количество вещества составляет 12*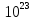 молекул этого вещества?
молекул этого вещества?
Задача №5.
Какое количество вещества составляет 0,6*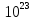 молекул этого вещества?
молекул этого вещества?
Задача №6.
Какое количество вещества составляет 3*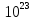 молекул этого вещества?
молекул этого вещества?
5). Для чего используют понятие молярная масса вещества. Определение, обозначение, размерность. Чему численно равна молярная масса вещества? Формулы для вычисления.
Задача №7.
Определить массу 0,5 моль железа?
Задача №8.
Определить массу 0,25 моль меди?
Задача №9.
Определить массу 2 моль углекислого газа?
Задача №10.
Сколько молей оксида меди составляет 160 г CuO?
Задача №11.
Сколько молей воды соответствуют 30г воды?
Задача №12.
Сколько молей магния соответствует его 40г?
§17 (с.41-44) упр.9 с.47
Приветствие учителя.
Отвечают на вопросы учителя, используя предыдущий
материал.
Определяют вместе с учителем ключевое слово.
Совместно с учителем формулируют проблему.
Самостоятельно формулируют цели.
Самостоятельно формулируют задачи.
Формулируют гипотезу с помощью учебника с.
Самостоятельно работают с текстом учебника §17 с.42-44 по вопросам и записывают в рабочую тетрадь. В рабочих тетрадях решают задачи совместно с учителем.
Записывают домашнее задание.