- Учителю
- Конспект урока химии 8 класс Тема: 'Кристаллические решетки'
Конспект урока химии 8 класс Тема: 'Кристаллические решетки'
Приложение 1
Ковалентная полярная связь
Ковалентная неполярная связь
Ионная связь
Н2, НСl,NaCl,O2, MgBr2, H2O.
Приложение 2

Приложение 3
Высокая температура плавления
Растворимые
Твёрдые
Газы
Жидкости
Низкая температура плавления - газы
Малорастворимые
Атомы одного неметалла
Признаки
Типы кристаллических решёток
Атомные
Молекулярные
Ионные
-
Тип химической связи
Ковалентная неполярная
Ковалентная полярная
Ионная
-
Агрегатное состояние
Твёрдые, газы, жидкости
Газы, жидкости
Твёрдые
-
Температура плавления
Низкая - газы, высокая - твёрдые
Выше, чем в атомной
Высокая
-
Растворимость в воде
Малорастворимые, нерастворимые
Малорастворимые
Растворимые
-
Примеры
Графит, алмаз, H2,O2
H2O, HCl
NaCl, MgBr2Атомы разных неметаллов
Металл и неметалл
Нерастворимые
Графит, алмаз
Высокая температура - твёрдые
Выше, чем в атомной
Приложение 4
Зависимость физических свойств веществ от строения
Урок химии 8 класс Тема: "Кристаллические решетки"/
Цель урока: изучение типов кристаллических решеток
Обучающая - изучить новое понятие "Кристаллические решётки", их виды на основе знаний о строении веществ.
Развивающая - продолжить формирование взаимосвязи между строением вещества и его свойствами, совершенствовать умение анализировать, сравнивать, устанавливать причинно-следственные связи, ассоциировать.
Воспитательная - здоровьесбережение, эстетическое воспитание, умение работать в парах и группах.
Оборудование урока.
ХОД УРОКА
I. Организационный момент - знакомство с темой и целями урока.
Здоровьесберегающий аспект (ЗСА):
Учитель: Каково настроение на начало урока?
Ученики, пользуясь карточкой-настроение, определяют свою психологическую готовность к уроку (весёлое, грустное, рабочее, нет настроения)
II. Актуализация мыслительной деятельности учащихся.
Выполнение тестовой работы "Виды химической связи"
Задачи: повторить виды химических связей, особенности образования связей.
Выберите правильный ответ:
1. В молекуле H2 тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
2. В молекуле HCl тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
3. В молекуле NaCl тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
4. В образовании ковалентной неполярной связи принимают участие:
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
5. В образовании ковалентной полярной связи принимают участие:
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
6. В образовании ионной связи принимают участие :
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
Итог выполнения работы - взаимопроверка по парам (1 - б, 2 - а, 3 - в, 4 - а, 5 - в, 6 - б).
Учитель: А теперь вам предлагается устный словарный диктант по теме "Химическая связь". ():
-
Перечислить виды химических связей.
-
Распределить данные вещества по видам связей.
Итог актуализации - виды химической связи необходимы для рассмотрения понятия "Кристаллические решётки", их видов, особенностей физических свойств веществ в зависимости от типа кристаллической решётки.
III. Новый материал.
Учитель: Как вы думаете, что такое кристаллические решётки? Попробуйте дать сами определение данного понятия.
Учащиеся пишут определения и вывешивают их на доске, читают определения друг у друга.
Делают общий вывод по данному определению. Проверяют правильность своих выводов по учебнику - стр. страница 131.
Учитель: Продолжить знакомство с новым понятием нам помогут препараты поваренной соли и клея. Просмотрите их под микроскопом и сделайте вывод о внутреннем строении веществ, пользуясь материалом из справочников и энциклопедий, который вы подбирали в домашнем задании.
Учащиеся предлагают название увиденным веществам по строению: поваренная соль - кристаллическое вещество, клей - аморфное вещество.
ЗСА:
Учитель: А можете вы найти похожие по строению вещества на наших суприматических композициях? ().
Учащиеся в суприматических композициях пробуют найти аморфные и кристаллические вещества.
Учитель: Понятие кристаллические решётки мы с вами будем рассматривать, опираясь на понятие кристаллических веществ. Вам предлагается выразить ваше представление о кристалличности в рисунках.
ЗСА: учащиеся рисуют свои представления о кристалличности в рисунках.
Учитель: А теперь попробуйте построить кристаллическое вещество, пользуясь пластмассовыми шариками. Взяв шарики в руку, верните их назад в фарфоровую чашку и посмотрите форму, образуемую ими.
Учащиеся наблюдают образование правильных форм - квадрат, шестиугольник.
Учитель: Ещё раз мы с вами убедились в образовании кристаллического вещества. Но различают несколько видов кристаллических решёток - атомные, молекулярные и ионные. Я предлагаю вам самим попробовать построить данные виды решёток: 1 ряд - атомная решётка, 2 ряд - молекулярная решётка, 3 ряд - ионная решётка.
ЗСА: учащиеся, пользуясь пластилином, лепят кристаллические решётки своих видов.
Учитель: А теперь попробуйте построить кристаллические решётки из самих себя.
Физкультурная пауза: учащиеся встают и изображают свой вид кристаллической решётки.
Учитель: Вы молодцы! А теперь сравните всё, что вы предлагали по своему виду решётки с готовыми моделями. Сделайте соответствующие выводы о сходстве и различии образцов и ваших моделей.
Учащиеся проводят сравнение и делают выводы.
Учитель: Мы уже не первый урок обращаем внимание с вами, что строение веществ определяет свойства вещества. Вам предлагается самостоятельно предложить свойства веществ для своего вида кристаллической решётки. На каждый ряд пришла бандероль с 3 конвертами. Сейчас вы должны воспользоваться конвертом № 1 ()
Учащиеся разбирают предложенные надписи для таблицы и оформляют её на доске:
Зависимость физических свойств веществ от их строения
Признаки
Типы кристаллических решёток
Атомные
Молекулярные
Ионные
1. Тип химической связи
2. Агрегатное состояние веществ
3. Температура плавления веществ
4. Растворимость в воде
5. Примеры
Учитель: Правильность заполнения таблицы можно проверить, вскрыв конверт № 2 (). Данную таблицу можно вклеить себе в тетрадь.
Учащиеся проверяют таблицу на доске и вклеивают в тетрадь образец.
IV. Закрепление материала.
Учитель: Подводя итог нашему уроку, вам предлагается вскрыть конверт № 3 () и отметить какой-то тип кристаллических решёток в задании "Крестики - нолики".
Учащиеся выполняют работу и сдают дежурному по ряду.
ЗСА.
Учитель: Покажите мне ваше настроение на конец урока. Вижу, что для многих этот урок был интересен, и настроение улучшилось. Я благодарю вас за урок. Открываем дневники, записываем домашнее задание.
V. Домашнее задание.
-
Изготовить кристаллическую решётку алмаза, воспользовавшись данными справочников или энциклопедий.
-
Подготовить творческую работу (тест, кроссворд, головоломку, "Крестики - нолики", химическую сказку и др.) по темам "Химическая связь" и "Кристаллические решётки".
-
Выберите правильный ответ:
-
1. В молекуле H2 тип связи:
-
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
-
2. В молекуле HCl тип связи:
-
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
-
3. В молекуле NaCl тип связи:
-
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
-
4. В образовании ковалентной неполярной связи принимают участие:
-
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
-
5. В образовании ковалентной полярной связи принимают участие:
-
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
-
6. В образовании ионной связи принимают участие :
-
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
Карточка №4
Распределите вещества пот классам
1 группа: K2SO4, HCl, MgO, HNO3, CO2, Ca(OH)2, Fe(OH)3, AlCl3, Na2O
-
группа: Fe2O3, H2SO4, Na3PO4, ВаСI2, Al(OH)3,P2O5,H3PO4, CuCO3, NaOH
-
3 группа: MgSO4, BaCl2, N2O5, HNO3, K2O, NaOH, CO2, CaO, H2S
-
группа: H2SO3; Na2SO4; Fe2O3; HBr; HNO3; Ca(OH)2; SO2; H2S; NaCl.
5 группа: Mg(ОН)2;; BaSО4, Nа2O, HNO3, Cu(OH)2, NaOH, H2CO3, Ba(OH)2, H2S.
___________________________________________________________________________
Карточка №3
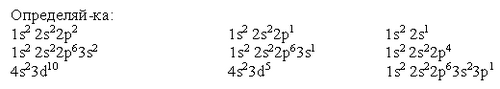
___________________________________________________________________________
Карточка №2
игра "Называй-ка".
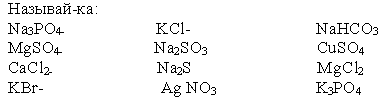
___________________________________________________________________________________
Карточка№4
игра "Составляй-ка".

-
Написать соединения с кислородом.
-
Как можно получить оксиды из простых веществ?
Атомная кристаллическая решётка
NH3
NaI
I2
CH4
F2
NaF
Cl2
N2
NaCl
N2
I2
HF
S8
F2
H2O
CH4
Cl2
HI
Молекулярная кристаллическая решётка
CH4
H2S
HCl
NH3
N2
H2O
Br2
HF
HI
Cl2
CH4
HF
N2
HCl
AlN
H2O
I2
H2S
Приложение 5
Ионная кристаллическая решётка
H2S
CH4
KBr
HCl
NaCl
H2O
CaCl2
NaI
H3P
H2O
CaF2
NaF
KCl
N2
KBr
Cl2
NH3
LiI