- Учителю
- Конспект урока по химии на тему 'Кислоты, их состав и названия' (8 класс)
Конспект урока по химии на тему 'Кислоты, их состав и названия' (8 класс)
Урок по теме: «Кислоты, их состав и названия».
Цели урока: познакомить учащихся с составом, названиями, классификацией и представителями класса кислот
Задачи урока:
Образовательная: сформировать знания учащихся о кислотах, их составе, способах классификаций и названий представителей класса кислот;
Развивающая: совершенствовать умения экспериментировать, наблюдать, анализировать, делать выводы, умения слушать и слышать другого человека, развить у учащихся умение обобщать, сравнивать, выделять самое необходимое;
Воспитательные: продолжить формирование диалектико-материалистического мировоззрения учащихся об окружающих их веществах, воспитывать личностные качества учащихся и расширять их кругозор,обратить внимание учащихся на правила работы с кислотами.
Тип урока: комбинированный
Ход урока.
-
Организационный момент.
Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих.
-
Проверка домашнего задания и усвоения основных понятий предыдущих уроков.
Фронтальный опрос.
Какие вещества (соединения) называются оксидами?
Какие вещества (соединения) называются основаниями?
Какие реакции называются качественными?
Как называются вещества, с помощью которых производят распознавания ?
Какие знаете индикаторы?
Как меняется их окраска в растворе оснований?
Что такое «амфотерность»?
Задания 1. Напишите уравнения реакций соединения с водой оксидов натрия, углерода (IV), кальция, серы (IV).
Задания 2. Напишите уравнения реакции, с помощью которых можно осуществить следующее превращение:
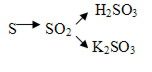
3. Актуализация знаний.
Сегодня мы продолжим изучение веществ. А вот каких именно?
Посмотрите на картинки, которые я вам принесла.
Как видите, здесь представлены плоды, продукты питания. А что же между ними общего? Как вы думаете?
Вспомните вкус аскорбинки, яблока, лимона.
Кислоты довольно распространены в природе. Лимонная кислота в плодах лимонов, яблочная -в яблоках, щавелевая - в листьях щавеля. При скисании молоко образуется молочная кислота, а в выделениях муравьев содержится муравьиная кислота.
Серную, соляную, азотную, фосфорную кислоты получают искусственным путем.
В кабинете химии чаще всего используют растворы кислот - соляной и серной. Они попадая на кожу, вызывают раздражение. Концентрированная серная кислота разъедает ткани, бумагу, кожу. Следует очень осторожно обращаться с ними. В случае попадания на руки и одежду кислоты, нужно быстро смыть её водой, затем раствором соды.
4. Изучение нового материала.
Итак сегодня мы будем изучать Кислоты.
Запишите тему урока в тетрадях.
Сейчас я на доске запишу формулы некоторых кислот, а вы сделайте вывод, что же в их строении общего и почему они объединены в один класс:
HCl, H2SO4, HNO3, H3PO4, HBr, H2CO3. (Наличие водорода).
В состав кислот обязательно входит водород. Причём водород всегда стоит на первом месте в формуле соединения. Вся остальная часть молекулы называется кислотным остатком.
Кислоты - это сложные вещества, имеющие в своём составе кислотный остаток и водород, способный замещаться на металл.
Записываем уравнение реакции на доске: 2HCI + Zn = Zn CI2+H2
Классификация кислот.
Обратите внимание на формулы кислот, которые написаны на доске.
Состав кислотных остатков различен: в одни входит кислород, в другие не входит, различно содержание атомов водорода. Учитель разъясняет, что классифицировать кислоты можно по нескольким признакам:
-по числу атомов водорода;
-по наличию кислорода в кислотном остатке;
-по растворимости;
- по силе кислот.
Классификация кислот
I. По числу атомов водорода (основность кислот):
одноосновные двухосновные трехосновные
(HCl, HNO3) (H2S, H2SO4, H2CO3) (H3PO4)
II. По наличию кислорода:
бескислородные кислородсодержащие
(HCl, H2S) (HNO3 ,H2SO4, H2CO3, H3PO4)
III. По растворимости :( по таблице растворимости определяются кислоты растворимые в воде и нерастворимые)
растворимые нерасворимые
HCl H2SO4 H2SiO3
IV. По силе кислот:
Сила кислот убывает в ряду:
HI > HBr > HCl > H2SO4 > HNO3 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3
Номенклатура кислот.
Номенклатура неорганических кислот прошла долгий путь развития и складывалась постепенно. Наряду с систематическими названиями кислот широко применяются традиционные и тривиальные. Некоторые распространённые кислоты могут в различных источниках иметь разные названия: например, водный раствор HCl может именоваться соляной, хлороводородной, хлористоводородной кислотой.
Традиционные русские названия кислот образованы прибавлением к названию элемента морфем -ная или -овая (хлорная, серная, азотная, марганцовая).
Учитель составляет таблицу с названиями кислот, кислотных остатков и названий кислотных остатков:
Кислота
Кислотный остаток
Название кислотных остатков
HCl - соляная
Cl (I)
хлорид
HBr- бромоводородная
Br (I)
бромид
HI- иодоводородная
I (I)
йодид
HF-фтороводородная( плавиковая)
F (I)
фторид
H2S- сероводородная
S (II)
сульфид
H2SO4- серная
SO4 (II)
сульфат
HNO3- азотная
NO3 (I)
нитрат
H2SiO3- кремниевая
SiO3 (II)
силикат
H2SO3- сернистая
SO3 (II)
сульфит
HNO2- азотистая
NO2 (I)
нитрит
H2CO3 -угольная
CO3 (II)
карбонат
H3PO4-ортофосфорная
PO4 (III)
ортофосфат
Кислота и соответствующий ей кислотный оксид:
H2SO4 - SO3 H2SO3 - SO2 HNO2 - N2O3 H2SiO3 - SiO2
HNO3 - N2O5 H3PO4 - P2O5 H2CO3 - CO2
ФИЗКУЛЬТМИНУТКА
-
выполнить приседания столько раз, сколько валентность у атома алюминия.
-
выполнить наклоны влево столько раз, сколько валентность свинца в его гидроксиде.
-
выполнить наклоны вправо столько раз, сколько в таблице растворимости нерастворимых оснований.
-
выполнить наклоны вперед столько раз, сколько в таблице растворимости щелочей.
-
Найти на себе или на своих предметах цвет лакмуса в щелочах.
-
Найти на себе или на своих предметах цвет фенолфталеина в щелочах.
-
Найти на себе или на своих предметах цвет метилоранжа в щелочах.
Физические свойства.
Многие кислоты, например серная, азотная, соляная - это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорнаяHPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты - кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Правила техники безопасности при смешивании серной кислоты с водой.
Сначала вода, затем кислота,иначе случится беда!
V.Закрепление
1) Дан текст, в котором «спрятаны» формулы кислот.
Выпишите их.
H2OSOHBrNa2Co3MgBSO4KOH
H3PO4P2O5CaH2SKPHNH3O3C
HClBaSHKSHH2Na2OHClH2SO4
2) Игра «Слабое звено»
1. Какой химический знак кислорода?
2. Какую валентность имеет кислород?
3. Что такое оксид?
4. Какой химический знак водорода?
5. Какую валентность имеет водород в кислотах?
6. Что называется кислотой?
7. Какая существует классификация кислот по основности?
8. Что входит в состав кислоты?
9. Какое другое название имеет оксид водорода?
10. Какая кислота содержится в лимоне?
3) В каждом ряду найдите лишнюю формулу, ответ мотивируйте:
1. H3PO4 H2SO4 HCl
2. H2SiO3 H2SO3 H3PO4
4) Дайте характеристику следующим кислотам HCl, HNO3, H2SiO3
по плану:
1.наличие кислорода
2.основность
3.растворимость
4.степени окисления элементов, образующих кислоту
5.заряд иона, образуемого кислотным остатком
6.соответствующий оксид
VI. Домашнее задание:
1. Выучить формулы и названия кислот
2. п. 44, упр.1,3 стр.152.