- Учителю
- Конспект урока Реакции ионного обмена и условия их протекания
Конспект урока Реакции ионного обмена и условия их протекания
Дата класс 9
Тема: Реакции ионного обмена и условия их протекания.
Лабораторный опыт №1 Реакции обмена между растворами электролитов.
Цель: сформировать представление учащихся о реакциях, протекающих межу ионами, условий протекания реакций ионного обмена до конца, обратимых реакциях, полных и сокращенных ионных уравнениях.
Задачи:
Задачи урока:
Образовательные:
Актуализировать и углубить знания о ТЭД; рассмотреть реакции обмена в свете представлений ТЭД; сформировать у учащихся представление о сущности реакций ионного обмена; продолжить формировать навыки составления уравнений диссоциации электролитов, сформировать навыки написания полных и сокращенных ионных уравнений.
Развивающие:
Продолжить развивать умения применять знания и собственный опыт в различных ситуациях: способствовать развитию мышления, анализу полученных знаний, выделения главного, обобщения и систематизации.
Воспитательные:
Создать условия для формирования культуры умственного и практического труда, интереса к знаниям, умений проводить самооценку. Содействовать формированию гуманности, доброты, толерантности, ответственности.
Метод обучения: частично-поисковый. словесный, наглядный
Формы работы: фронтальная, групповая, индивидуальная.
Опорные знания: Основные положения ТЭД, диссоциация кислот, щелочей, солей.
Базовые понятия и термины: растворы, электролиты, неэлектролиты, растворенное вещество, электролитическая диссоциация, ионы, катионы, анионы, химическая связь, сильные и слабые электролиты, степень диссоциации, реакции обмена.
Структура урока
1.Организационный этап………………………………………1 мин.
2.Проверка домашнего задания……………………………... 7 мин.
3. Актуализация опорных знаний…………………………. 3 мин.
4.Изучение нового материала……………………………….20 мин.
1.Реации ионного обмена и условия их протекания.
2.Реакции с образованием воды.
3.Реакции с образованием осадка.
4.Реакции с выделением газа.
5. Лабораторная работа………………………………………..5 мин
6.Обобщение и закрепление знаний………………………8 мин.
7.Домашнее задание…………………………………………..1 мин.
-
Организационный момент - 1 мин:
Приветствие Здравствуйте, ребята! Я рада вас приветствовать сегодня на уроке.
, проверка готовности к уроку, организация внимания учащихся),
информация о цели и ходе урока, мотивация
Сегодня вы должны научиться применять полученные знания по теме «ТЭД» в новой нестандартной ситуации.
2.Проверка домашнего задания (7 мин).
Фронтальный опрос по материалам предыдущих уроков:
1.Какие вещества называются электролитами? Приведите примеры.
1.Вещества, проводящие электрический ток в водных растворах или расплавах. Например: раствор или расплав поваренной соли .
2. Какие вещества называются неэлектролитами? Приведите примеры.
2.Вещества, которые в растворенном или расплавленном состоянии не проводят электрический ток. Например: газы и орг.вещества.
-
Что такое реакции обмена? (это реакции между двумя сложными веществами, при которых они обмениваются своими составными частями).
-
Что такое ионы? (это заряженные частицы, которые отличаются от атомов числом электронов)
-
На какие группы делятся ионы? (катионы - положительные ионы; анионы - отрицательные ионы)
-
Что такое электролитическая диссоциация? (процесс распада молекул электролитов на ионы при растворении в воде или расплавлении)
-
На какие ионы распадаются при электролитической диссоциации кислоты (ионы водорода и ионы кислотного остатка)
-
На какие ионы распадаются при электролитической диссоциации растворимые основания? (ионы металла и ионы ОН-1 групп)
-
На какие ионы распадаются при электролитической диссоциации соли? (ионы металла и ионы кислотного остатка)
-
Таким образом, какие ионы выделяют при электролитической диссоциации? (Н+1, ОН-1, Ме+n, кислотный остаток-n)
Именно эти ионы находятся в таблице растворимости: (Работа с таблицей растворимости - определение растворимых и нерастворимых веществ)
3. Актуализация опорных знаний (3 мин).
Парная работа :
1. Перечисленные названия веществ разделите на два столбика: в один запишите - электролиты, в другой - неэлектролиты.
Раствор гидроксида калия, твердый гидроксид калия, кристаллы сахара, раствор сахара, дистиллированная вода, серная кислота, спирт.
2.Написать уравнения диссоциации следующих веществ:
KNO3, Ba(OH)2, HCl, Na2SO4
</ 4. Изучение нового материала. Объяснение учителя. 20 мин.
Реакции обмена протекают между ионами, поэтому называются реакции ионного обмена запишем в тетради определение
Реакции ионного обмена идут до конца в трех случаях:
Запишем обозначение
-
если образуется осадок - нерастворимое вещество после реакции)
-
если выделяется газ
-
если образуется вода
В остальных случаях реакции обмена являются обратимыми
Разберем эти случаи поподробнее (случаи разбираются на слайдах и на доске, проводится фронтальная беседа: почему реакция идет, что и почему образуется, как определить образование осадка, газа, воды и т.п.):
1) Если образуется осадок :
а) CuSO4 + 2NaOH ![]() Na2SO4 + Cu(OH)2
Na2SO4 + Cu(OH)2![]()
б) 2AgNO3 + CaCl2 ![]() Ca(NO3)2 + 2AgCl
Ca(NO3)2 + 2AgCl![]()
в) Na2CO3 + Ca(NO3)2
![]() 2NaNO3 + CaCO3
2NaNO3 + CaCO3![]()
г) BaCl2 + K2SO4 ![]() 2KCl + BaSO4
2KCl + BaSO4![]()
2) Если выделяется газ:
а) CaCO3 + 2HNO3 ![]() Ca(NO3)2 + H2CO3
(H2O + CO2
Ca(NO3)2 + H2CO3
(H2O + CO2 ![]() )
)
б) Na2SO3 + 2HCl ![]() 2NaCl + H2SO3 (H2O + SO2
2NaCl + H2SO3 (H2O + SO2
![]() )
)
в) CuS + 2HCl ![]() CuCl2 + H2S
CuCl2 + H2S ![]()
3) Если образуется вода :
а) CuO + H2SO4 ![]() CuSO4 + H2O
CuSO4 + H2O
б) Fe(OH)3 + 3HCl ![]() FeCl3 + 3H2O
FeCl3 + 3H2O
в) NaOH + HNO3 ![]() NaNO3 + H2O
NaNO3 + H2O
4) Если НЕ образуются осадок, газ и вода, то реакции являются обратимыми:
Определение:
Обратимые реакции - это реакции, которые при одних и тех же условиях протекают в двух противоположных направлениях
а) 2NaNO3 + CaCl2 ![]() Ca(NO3)2 + 2NaCl
Ca(NO3)2 + 2NaCl
б) K3PO4 + 3NaCl ![]() Na3PO4 + 3KCl
Na3PO4 + 3KCl
в) CuCl2 + Na2SO4 ![]() CuSO4 + 2NaCl
CuSO4 + 2NaCl
Ионные уравнения
Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы никогда не раскладывают :
-
нерастворимые вещества (см. таблицу растворимости);
-
оксиды;
-
воду;
-
газы
1) Запишем молекулярное уравнение и уравняем его:
CuSO4 + 2NaOH ![]() Na2SO4 + Cu(OH)2
Na2SO4 + Cu(OH)2![]()
2) Разложим на ионы все, что возможно и затем сократим одинаковые ионы в обоих частях уравнения:
Cu+2 + SO4-2 + 2Na+1
+ 2OH-1 ![]() 2Na+1 + SO4-2 + Cu(OH)2
2Na+1 + SO4-2 + Cu(OH)2
![]() (полное
ионное уравнение)
(полное
ионное уравнение)
3) Запишем то, что получилось:
Cu+2 + 2OH-1 ![]() Cu(OH)2
Cu(OH)2 ![]() (сокращенное ионное уравнение)
(сокращенное ионное уравнение)
Другие примеры составления ионных уравнений (разбираются с пояснениями):
Пример 2.
CaCO3 + 2HNO3 ![]() Ca(NO3)2 + H2CO3
(H2O + CO2
Ca(NO3)2 + H2CO3
(H2O + CO2![]() )
)
CaCO3 + 2H+1 +
2NO3-1 ![]() Ca+2 + 2NO3-1 + H2O +
CO2
Ca+2 + 2NO3-1 + H2O +
CO2![]()
CaCO3 + 2H+1 ![]() Ca+2 + H2O + CO2
Ca+2 + H2O + CO2 ![]()
Пример 3.
CuS + 2HCl ![]() CuCl2 + H2S
CuCl2 + H2S![]()
CuS + 2H+1 + 2Cl-1 ![]() Cu+2 + 2Cl-1 + H2S
Cu+2 + 2Cl-1 + H2S![]()
CuS + 2H+1 ![]() Cu+2 + H2S
Cu+2 + H2S![]()
Пример 4.
NaOH + HNO3 ![]() NaNO3 + H2O
NaNO3 + H2O
Na+1 + OH-1 + H+1 +
NO3-1 ![]() Na+1 + NO3-1 + H2O
Na+1 + NO3-1 + H2O
OH-1 + H+1 ![]() H2O
H2O
Пример 5.
K3PO4 + 3NaCl ![]() Na3PO4 + 3KCl
Na3PO4 + 3KCl
3K+1 + PO4-3 + 3Na+1
+ 3Cl-1 ![]() 3Na+1 + PO4-3 + 3K+1 +
3Cl-1
3Na+1 + PO4-3 + 3K+1 +
3Cl-1
Вывод: сокращенного ионного уравнения нет, следовательно, у обратимых реакций нет сокращенных ионных уравнений
5 Лабораторная работа.№1 (групповая)
Тема: Реакции ионного обмена между растворами электролитов.
Цель : отработать алгоритм составления реакций ионного обмена, знать условия протекания реакций ионного обмена.
Группа 1: Взаимодействие растворов хлорид натрия и нитрат серебра (I) или нитрат свинца (II).
Группа 2: Взаимодействие растворов карбоната натрия и соляной кислоты.
Группа 3: Взаимодействие растворов азотной кислоты и гидроксида калия.
Группа 4: Взаимодействие растворов хлорид магния и сульфат натрия.
В процессе выполнения лабораторной работы учащиеся заполняют таблицу.
6. Обобщение и закрепление знаний (10 мин).
Учащимся предлагается выполнить задания в парах. Каждое задание предлагается на слайде и проверяется на следующем слайде
Задание 1
Саша и Алеша делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным
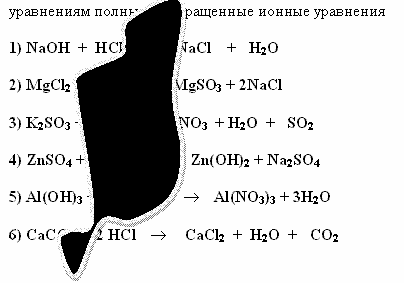
Проверка задания 1 .
1) NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
Na+1 + OH-1 + H+1 +
Cl-1 ![]() Na+1 + Cl-1 + H2O
Na+1 + Cl-1 + H2O
OH-1 + H+1 ![]() H2O
H2O
2) MgCl2 + Na2SO3 ![]() MgSO3
MgSO3 ![]() +
2NaCl
+
2NaCl
Mg+2 + 2Cl-1 + 2Na+1
+ SO3-2 ![]() MgSO3
MgSO3 ![]() +
2Na+1 +2Cl-1
+
2Na+1 +2Cl-1
Mg+2 + SO3-2 ![]() MgSO3
MgSO3 ![]()
3) K2SO3 + 2HNO3 ![]() 2KNO3 + H2O + SO2
2KNO3 + H2O + SO2 ![]()
2K+1 + SO3-2 + 2H+1
+ 2NO3-1 ![]() 2K+1 + 2NO3-1 + H2O +
SO2
2K+1 + 2NO3-1 + H2O +
SO2 ![]()
SO3-2 + 2H+1 ![]() H2O + SO2
H2O + SO2 ![]()
4) ZnSO4 + 2NaOH ![]() Zn(OH)2
Zn(OH)2 ![]() + Na2SO4
+ Na2SO4
Zn+2 + SO4-2 + 2Na+1
+ 2OH-1 ![]() 2Na+1 + SO4-2 + Zn(OH)2
2Na+1 + SO4-2 + Zn(OH)2
![]()
Zn+2 + 2OH-1 ![]() Zn(OH)2
Zn(OH)2 ![]()
5) Al(OH)3 + 3HNO3 ![]() Al(NO3)3 + 3H2O
Al(NO3)3 + 3H2O
Al(OH)3 + 3H+1 +
3NO3-1 ![]() Al+3 + 3NO3-1 + 3H2O
Al+3 + 3NO3-1 + 3H2O
Al(OH)3 + 3H+1 ![]() Al+3 + 3H2O
Al+3 + 3H2O
6) CaCO3 + 2 HCl ![]() CaCl2 + H2O + CO2
CaCl2 + H2O + CO2 ![]()
CaCO3 + 2H+1 + 2Cl-1 ![]() Ca+2 + 2Cl-1 + H2O + CO2
Ca+2 + 2Cl-1 + H2O + CO2
![]()
CaCO3 + 2H+1 ![]() Ca+2 + H2O + CO2
Ca+2 + H2O + CO2 ![]()
IV. На следующем уроке мы продолжим разбирать тему "Реакции ионного обмена" и напишем небольшую проверочную работу, а сейчас ....
7. Домашнее задание
Параграф 9 упр. 3 стр. 36 и ... не забудьте составить полные и сокращенные ионные уравнения
Приложение 1
СОСТАВЛЕНИЕ ИОННЫХ УРАВНЕНИЙ Правила:
1.Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли не диссоциируют.
2.Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3.Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4.Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
1. Записать молекулярное
уравнение реакции.
2. С помощью таблицы
растворимости определить
растворимость каждого
вещества.
3. Составить полное ионное
уравнение.
4. Составить сокращенное
ионное уравнение
(найти одинаковые ионы и
сократить их слева и справа).
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
Р Р Н Р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3Na+ + 3OH + Fe3+ + 3Cl = Fe(OH)3 + 3Na+ + 3Cl
3Na+ + 3OH + Fe3+ + 3Cl = Fe(OH)3 + 3Na+ + 3Cl
3OH + Fe3+ = Fe(OH)3
7