- Учителю
- Урок по химии в 9 классе по теме «Железо и его соединения»
Урок по химии в 9 классе по теме «Железо и его соединения»
Тема урока:
"Железо: химический элемент и простое веществ" (9класс)
Учитель химии МБОУ
"Яшкульская многопрофильная гимназия"
Гапотченко Ирина Викторовна
Цели урока: создать условия для исследования учащимися физических и химических свойств железа на основе строения его атома, дальнейшего развития общеучебных и предметных умений (анализировать, сравнивать, делать выводы, экспериментально решать задачи, составлять молекулярные и ионные уравнения химических реакций), развития логико-смыслового мышления учащихся, памяти, химического языка; развивать их умение осуществлять самостоятельную деятельность на уроке; воспитывать культуру умственного труда, развивать коммуникативные качества личности.
Метод обучения: проблемный.
Организационные формы: беседа, самостоятельная работа, практическая работа.
Средства обучения: инструкция, химическое оборудование, таблицы.
Демонстрационное оборудование: таблицы, демонстрационный штатив, стеклянная трубочка, воронка бумажная, железо восстановленное, спиртовка, спички.
Оборудование на столах учащихся: железный гвоздь, раствор сульфата меди, соляная кислота, штатив для пробирок, спиртовка, спички, держатель для пробирок.
I. Мотивация. Актуализация знаний
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет -
Из элементов состоит единых.
С. Щипачев
У каждого из нас есть свой адрес: это улица, дом, квартира. У химических элементов тоже есть свой "дом". Как он называется? Какие "адреса" имеют химические элементы? Сегодня мы познакомимся с одним из "жильцов" этого "дома". Внимательно послушайте загадку и вы должны будете угадать о каком металле идет речь.
Среди металлов самый славный,
Важнейший древний элемент.
В тяжелой индустрии - главный,
Знаком с ним школьник и студент.
Родился в огненной стихии,
Расплав его течет рекой.
Важнее нет в металлургии,
Он нужен всей стране родной". ( Железо)
Сейчас вы отправитесь в путешествие, чтобы познакомиться с удивительным химическим элементом железом - и образованным им простым веществом. Тема нашего с вами урока:
" Железо: химический элемент и простое вещество".
II Изучение нового материала
Характеристика химического элемента
Учитель: Работая в паре, определите местоположение элемента в Периодической системе, составьте электронную формулу атома. Сделайте записи в тетради.
Порядковый номер:
Период:
Группа:
Подгруппа:
Электронная формула атома:
Учитель: Каково распространение железа в природе?
Содержание в земной коре. Важнейшие природные соединения
Ученик (сообщение): Железо - один из самых распространенных элементов в природе. В земной коре содержится 4,65% (по массе) железа. По распространенности железо занимает 4-е место после кислорода, кремния, алюминия. Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Важнейшие минералы (руды):
Fe3O4 - магнетит (магнитный железняк) Южный Урал, Курская магнитная аномалия
Fe2O3 - гематит (красный железняк)65% Fe , Криворожский район
Fe2O3nH2O - лимонит 60% Fe, в Крыму
FeCO3 - сидерит (шпатовый железняк)
FeS2 - пирит 47% Fe, на Урале
Редко встречается самородное железо (метеоритного или земного происхождения).
Содержание и формы существования в живых организмах. Биологическая роль
Железо - наиболее распространенный в организме d-элемент. В организме человека его содержится около 5 г. Суточная потребность в железе составляет 0,02 г.
Большая часть железа (около 70%) сосредоточена в гемоглобине крови.
Гемоглобин - красный пигмент эритроцитов.
В 100 мл крови в норме содержится около 15 г гемоглобина. Гемоглобин представляет собой сложный белок, молекула которого содержит 4 полипептидных цепи (глобин), каждая из которых связана с небелковой группой (гемом). Гем - это комплекс железа (II) с полициклическим органическим веществом - порфирином. Гем имеет структуру, показанную на рис. 7.
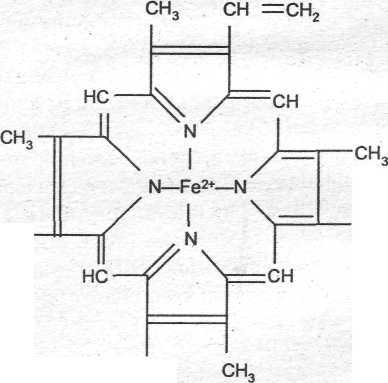
сн =сн2
ноос-сн2-сн2
ноос-сн2-сн2
Рис. 7. Структура небелковой части гемоглобина - гема
Как видно из этой формулы, в геме атом железа образует 4 связи с атомами азота пиррольных колец.
Железо содержится в составе сложных белков - ферритина и трансферрина. Трансферрин содержит два иона железа Fe3+, его молекулярная масса 90.000. Трансферрин является биологическим переносчиком железа по всему организму. Так, трансферрин переносит железо от ферритина в костный мозг, где образуется гемоглобин в новых эритроцитах. Железо участвует в процессах кроветворения и. его недостаток в организме приводит к болезни крови - железодефицитной анемии (малокровие). Избыток железа тоже вреден, так как железо, которое не связывается в биокомплексы, может вызвать нарушение деятельности сердечно-сосудистой системы, печени, легких.
Применение железа и его соединений в медицине
Искусственные изотопы железа 55Fe и 59Fe применяют в качестве изотопных индикаторов.
В медицинской практике применяются различные соединения железа.
Железный купорос FeSO4 • 7Н2О используют при лечении анемии, связанной с недостатком железа в организме.
Карбонат железа (II) FeCO3 применяют при слабости и истощении.
Восстановленное железо (Fe2+) назначают при слабости и истощении: оно входит в состав более 20 лекарственных средств, применяемых при лечении различных видов анемий.
Гексагидрат хлорида железа (III) FeCl3 • 6Н2О применяется наружно как дезинфицирующее и кровоостанавливающее средство.
Таблетки «Бло» (содержат FeSO4) используют при лечении железодефицитной анемии.
Физические свойства простого вещества
Работаем в парах
Запишите в тетради физические свойства вещества:
Цвет: Теплопроводность:
Запах: Электропроводность:
Металлический блеск: Плотность: 7,87 г/см. куб
Твердость: Температура плавления:
Пластичность:
Учитель: Каковы же химические свойства железа? ( таблица)
Проведем химический эксперимент.
Демонстрационный опыт: "Горение железа"
В штативе закрепим вертикально стеклянную трубку диаметром 1 см.Нижний конец трубки поместим над пламенем спиртовки, а верхний вставим воронку. Несколько минут нижний конец трубки прогреваем. Затем небольшими порциями в воронку насыпаем порошок металлического восстановленного железа.
Исследуем взаимодействие железа с соляной кислотой и раствором сульфата меди(II).
Не забывайте о правилах безопасности.
Учащиеся работают по инструкции
ИНСТРУКЦИЯ
Взаимодействие железа со сложными веществами.
Правила безопасности.
Соблюдайте осторожность при работе с растворами кислот. При нагревании прогревайте сначала всю пробирку. Направляйте ее отверстие в сторону от себя и соседей.
Опыт 1. Взаимодействие железа с раствором кислоты
В пробирку поместите железный гвоздь. Добавьте 1 мл соляной кислоты. Если реакция не происходит, содержимое пробирки слегка нагрейте.
Объясните наблюдаемое. Составьте уравнение химической реакции.
Опыт 2. Взаимодействие железа с раствором сульфата меди.
В пробирку поместите железный гвоздь. Добавьте 1 мл раствора сульфата меди.
Объясните наблюдаемое. Составьте уравнение химической реакции.
Учитель проверяет результаты практической работы: учащиеся кратко описывают свои наблюдения и читают уравнения реакций. Учитель дополняет заготовленные на доске схемы реакций.
Учащиеся делают вывод об активности железа.
III. Первичная проверка усвоения знаний
Вопрос: Постарайтесь узнать героев рассказа, под именами которых зашифрованы вещества.
Расскажите, о каких химических превращениях идет речь? Напишите соответствующие химические реакции.
Приключение с господином Ферром
Уставший господин Ферр пришел домой. Не успел он стряхнуть с себя металлическую пыль, как неожиданно к нему влетел Кисли и предложил создать совместное предприятие. Зная его коварный нрав, Ферр категорически отказался вступать с ним в контакт, но тут явилась очаровательная Аква и настолько легко вошла в доверие к Ферру, притупив его бдительность и осторожность, что Ферр не заметил, как Кисли вместе с Аквой овладели ситуацией. Ферр стал покрываться бурым налетом и выпадать в осадок. Так бы и пропал наивный Ферр, если бы на помощь не пришел Верный Газ, который заставил Ферра как следует прогреться, а затем постепенно восстановил его до прежнего состояния.
Ответ: Ферр - железо Fe,Кисли - кислород, Аква - вода, Газ - Угарный газ
IV Закрепление знаний
Викторина
-
Какие металлы наиболее распространены в земной коре? (Al, Fe)
-
Какие руды богаты железом? (Магнитный железняк, бурый, красный )
-
Железо в поэмах Гомера названо "многотрудным металлом". Почему его так называли? (В древние времена добывание железа требовало больших затрат труда. Кроме того, железо труднее поддается плавке, чем медь.)
-
Где железо будет быстрее ржаветь: в Яшкуле, в Элисте или в Москве? (в Москве, т.к. в этом городе много заводов , которые выделяют газы, способствующие тому , что на железе очень скоро появляется ржавчина.)
-
Измените последнюю букву в названии органа, вырабатывающего и выделяющего гормоны, и получите название серебристо-белого металла, который является главной составляющей частью чугуна и стали. (Железа - железо.)
V Итоги урока
Вернемся к теме нашего сегодняшнего урока.
Какую проблему мы поставили вначале его?
Удалось ли нам ее решить?
К какому выводу мы пришли?
Домашнее задание: на основе материала учебника и опорного конспекта составьте рассказ по данной теме. Составьте химическую сказку о железе.