- Учителю
- Урок в 10 классе «Принцип действия моющих средств»
Урок в 10 классе «Принцип действия моющих средств»
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа №9
с углублённым изучением английского языка»
Ново-Савиновского района г.Казани Республики Татарстан
Открытый урок
«Принцип действия моющих средств»
10 класс
Учитель химии Хайруллина Эсмеральда Васильевна
Девиз урока: «Да здравствует мыло душистое и полотенце пушистое!»
Цель урока:
Образовательная: Закрепить знания реакции гидролиза на примере мыла; познакомить со строением, получением и принципом действия СМС.
Развивающая: Осуществить межпредметную связь химии, биологии (понятие гидрофильность, гидрофобность), экологии, физики (поверхностное натяжение).
Анализировать материал, формирование умения излагать свою точку зрения, оппонировать; осознать, что любую сущность можно познать через преобразование.
Воспитательная: продолжать вырабатывать такие черты характера, как пытливость, любознательность, стремление к расширению своего кругозора, через индивидуальную работу и работу в группе, осознавать постепенно необходимость выработки умения самооценки и взаимооценки.
Методы: Рассказ, беседа, лабораторная работа.
Оборудование: Интерактивная доска SMART-BOARD, коллекции СМС, для лабораторной работы: растворы мыла хозяйственного, СМС, СаСl2, универсальный индикатор.
Тип урока: комбинированный.
Ход урока:
-
Организационный момент (1 мин)
-
Актуализация знаний (10 мин)
Классу показывается репродукции прачки художника Архипова «Прачки» и Ренуар «Прачки»
У читель - Обращает внимание на руки этих женщин - красные, опухшие, с жёсткой нездоровой кожей.
читель - Обращает внимание на руки этих женщин - красные, опухшие, с жёсткой нездоровой кожей.
Что является результатом этих необратимых процессов?
Учащиеся. Постоянное действие мыла.
Лабораторная работа
Учащимся предлагается:
-
Изучить рН растворов хозяйственного мыла, СМС.
-
Изучить поведение растворов мыла и СМС в жёсткой воде (создаётся добавлением к 3-5 мл дистиллированной воды 2-3 капель 5% раствора хлорида кальция).
Учащиеся фиксируют полученные результаты и выводы в тетрадь.
Учитель. Какие выводы вы записали в тетрадь по лабораторной работе №1? Что происходит при действии мыла? Записать на доске уравнение реакции.
Ученик. 1. Растворение мыла как соли сильного основания и слабой кислоты сопровождается гидролизом, при этом создаётся щелочная среда, которая оказывает вредное воздействие на многие ткани, особенно на шерсть, шёлк.
У равнение реакции записывается на доске:
равнение реакции записывается на доске:
С17Н35СООNа+НОН↔ С17Н35СООН + NаОН
С17Н35СОО-+Nа++НОН↔ С17Н35СООН + Nа++ОН-
С17Н35СОО-+НОН↔ С17Н35СООН+ОН-.
Учитель. Что происходит с раствором мыла и СМС в жёсткой воде? Чем отличается мыло от СМС? Перечисляем достоинства СМС и фиксируем на доске напротив свойств мыла.
Ученик. 2. В жёсткой и морской воде моющее действие мыла уменьшается (оно не мылится, не пенится) вследствие образования нерастворимых кальциевых или магниевых солей (в виде хлопьев):
Мыло
СМС
1. Моет только в горячей воде (уравнение гидролиза)
1. Моет в широком интервале температур (гидролизу не подвергаются, т.к. сульфокислоты являются сильными кислотами). Растворы СМС нейтральны.
2. Плохо моет в жёсткой воде:
2С17Н35СООК+СаCl2→
(С17Н35СОО)2Са↓+2KCl
2С17Н35СОО-+Са2+→(С17Н35СОО)2Са↓
2. Сохраняет моющее действие в воде любой жёсткости, т.к. образующиеся при этом кальциевые и магниевые соли растворимы.
3. Дефицитность сырья (получают в основном из натуральных жиров).
3. Сырьё получают из нефти:
2С16Н34+О2→2СН3(СН2)14СН2ОН
гексадекан цетиловый спирт
2СН3(СН2)14СН2ОН+НОSО3Н↔
СН3(СН2)14СН2ОSО3Н+Н2О
кислый сульфоэфир цетилового спирта
2СН3(СН2)14СН2ОSО3Н+Nа2СО3→
2СН3(СН2)14СН2ОSО3Nа+Н2О+СО2
синтетическое моющее средство
-
Изложение нового материала (15 мин).
Учитель - Вещества, которые лишены недостатков мыла были получены синтетическим путём и получили название детергентов или синтетических моющих средств. (Демонстрируем порошки).
-
Сравниваем строение молекул мыла и СМС:
Мыло
СМС
СН3-(СН2)16-СООNа
неполярная полярная
группа группа
СН3-(СН2)14-ОSO3Na
неполярная полярная
группа группа
2. Вспоминаем из курса общей биологии понятия гидрофильность (группы
-СООNа и -ОSO3Na - гидрофильная часть молекулы) и гидрофобность (углеводородные радикалы - гидрофобная часть).
Учитель. Какая группа в молекуле мыла и СМС обеспечивает растворимость в воде, а какая стремится вытеснить молекулу мыла (СМС) из внутренних слоёв воды на её поверхность?
Учащиеся. -СООNа - гидрофильная, обеспечивает растворимость молекулы мыла в воде; группа -С17Н35 - гидрофобная, стремится вытеснить «отработавшую» молекулу мыла на её поверхность. Это сочетание гидрофильности и гидрофобности различных частей молекулы мыла и обеспечивает её моющее действие.
Схема действия мыла (СМС) такова:
-
растворение молекулы мыла (СМС) в воде и подход к грязевой частице,
-
отрыв грязевых частиц от материала,
-
п
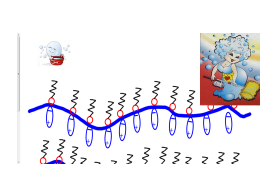 еревод грязевых частиц в моющий раствор и их удержание там.
еревод грязевых частиц в моющий раствор и их удержание там.
Грязь удерживается на ткани тонким слоем жиров, которые должны быть удалены в первую очередь. При стирке загрязнённой ткани молекулы моющего вещества окружают капли жира, так что неполярные группы (обозначены зигзагами) оказываются «растворёнными» в жире, а полярные в воде. В результате капли жира становятся гидрофильными и переходят в раствор. Мыла и моющие средства - хорошие пенообразователи. Загрязняющие частицы, прилипая к пузырькам пены, удаляются вместе с ней из моющего раствора.
3. Связь с физикой. Препятствием на пути подхода моющего вещества к поверхности грязевой частицы является поверхностное натяжение воды. Вспоминаем понятие поверхностного натяжения и как поверхностное натяжение меняется с добавлением детергентов. С добавлением детергентов поверхностное натяжение становится достаточно низким и поверхность материала легко смачивается мыльным раствором.
Коэффициенты поверхностного натяжения различных жидкостей
Жидкости
Коэффициент поверхностного
Натяжения, мН/м
Спирт этиловый
23
Ацетон
24
Бензин
29
Оливковое масло
32
Глицерин
63
Вода
73
Ртуть
440
Чем больше коэффициент поверхностного натяжения жидкости, тем с большей силой она будет стремиться минимизировать свою поверхность при прочих разных условиях. Измерения показывают, что молекулы мыла на поверхности воды понижают её поверхностное натяжение почти в 2,5 раза. Происходит это из-за того, что, находясь на поверхности воды «головой вниз», они, во-первых, не стремятся внутрь и, во-вторых, отталкиваются друг от друга, а не притягиваются, как молекулы воды. Таким образом, увеличивать поверхность воды, если в ней растворено мыло, легче. А это значит, что жидкость может проникать в щели между нитями ткани. Другими словами, мыло делает воду «более мокрой».
Какие же молекулы обеспечивают достоинства СМС?
-
ПАВ - поверхностно-активные вещества (меняют поверхностное натяжение), например, натрий-сульфоновый эфир цетилового спирта. (см. табл)
-
Полифосфаты (помогают повышать активность ПАВ, снижают жёсткость воды за счёт образования прочных, но растворимых в воде соединений с ионами магния и кальция), например, натрийтрифосфат:
O O O
║ ║ ║
Na─O─P─O─P─O─P─O─Na
│ │ │
ONa ONa ONa
-
Отбеливающие вещества, например, перборат NaBO2∙H2O2∙3Н2О
-
Отдушка.
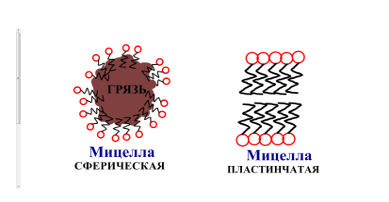
4. Разбираем вопрос, почему нужно строго придерживаться способа применения, который указан на коробке. При употреблении СМС в концентрации меньшей, чем указано на упаковке, полифосфата недостаточно, чтобы устранить жёсткость воды. ПАВ действует неэффективно. При употреблении СМС в концентрации большей, чем указано на упаковке, молекулы ПАВ реализуют свою склонность к склеиванию друг с другом - мицеллообразованию, в этом случае эффективность ПАВ также резко снижается. Разбираем строение мицелл (кружочками изображена гидрофильная часть молекулы, чёрточками - гидрофобная):
5. Экологический аспект.
Есть ли недостатки СМС? Да. СМС устойчивы и с трудом разрушаются, поэтому они способны накапливаться в окружающей среде и загрязнять её. Основную опасность в этом плане представляют полифосфаты (ПАВ сейчас стараются применять такие, что быстро подвергаются природой естественному разложению). Полифосфаты, содержащие в своём составе фосфор - один из важнейших питательных элементов, - попадая в водоёмы, вызывают бурное размножение планктона, «цветение» воды. Однако ситуация не безвыходная. Вместо полифосфатов с равным успехом можно использовать цитраты - соли лимонной кислоты. Цитрат натрия в сочетании с сульфатом натрия эффективно снижает жёсткость воды и не загрязняет окружающую среду (цитраты в природе быстро подвергаются разложению), их можно использовать в меньших количествах, чем полифосфаты, они создают при стирке менее щелочную среду. Основной сдерживающий фактор при использовании цитратов - более высокая себестоимость.
IV. Закрепление. (Проведение теста и взаимопроверка. Оценки выставляем в журнал)
-
Формула мыла:
А) С17Н35СООNa
Б) С17Н35СООН
В) С15Н31СООNa
-
Какая среда образуется при гидролизе мыла?
А) щелочная
Б) нейтральная
В) кислая
-
Жёсткость воды обусловлена ионами:
А) Са2+
Б) К+
В) Na+
-
Сырьём для получения СМС является:
А) попутные и нефтяные газы
Б) нефть
В) природное сырьё
-
Какая группа в молекулах СМС обеспечивает растворимость в воде?
А) гидрофобная
Б) гидрофильная
В) гидроксильная
-
В состав СМС входят:
А) полифосфаты
Б) отдушка
В) пероксид Na
Г) сода
Д) ПАВ
Е) аммиак
Ж) отбеливающие вещества
-
Какие вещества, содержащиеся в СМС, снижают жесткость воды?
А) ПАВ
Б) полифосфаты
В) отбеливающие вещества
V. Домашнее задание (подготовить устный ответ на вопросы:
1. Почему вещи стирают в горячей воде, а споласкивают в холодной?
2. Есть ли смысл использовать антибактериальные мыла и СМС?
 VI. Рефлексия
VI. Рефлексия