- Учителю
- Конспект урока химии в 9 классе по теме 'Галогены'
Конспект урока химии в 9 классе по теме 'Галогены'
Государственное бюджетное специальное
(коррекционное) образовательное учреждение Республики Хакасия «Специальная (коррекционная) общеобразовательная школа-интернат
III, IV видов»
Конспект урока по химии
в 9 классе
«Галогены»
подготовила
учитель химии и биологии
Смирнова Людмила Алексеевна
г Абакан
2014г
Конспект урока.
Автор: Смирнова Людмила Алексеевна, учитель химии и биологии ЦДО,
ГБС(К) ОУ РХ С(К)ОШИ III, IV видов, г Абакан.
Предмет: химия.
9 класс.
УМК О.С.Габриелян, 9 класс,
Тема урока: обобщающий урок по теме «Галогены»
Тип урока: закрепления и углубления изученного материала.
Цель урока: обобщить, углубить и систематизировать знания, умения и навыки
по теме «Галогены»
Задачи урока:
Образовательные: продолжить формирование знаний о галогенах, как типичных неметаллах и типичных окислителях.
Развивающие: создавать условия для формирования навыков наблюдать, обобщать
и делать выводы.
Воспитательные: способствовать развитию коммуникативного общения при работе
в группах.
Здоровьесберегающая: обеспечить безопасные условия при проведении химических
экспериментов, учитывать индивидуальные особенности здоровья
обучающихся.
Формы работы на уроке: индивидуальная, групповая, индивидуальная.
Используемые УУД: личностные, регулятивные, коммуникативные, познавательные.
Тип мышления: связи новых знаний с предыдущими.
Мыслительные приемы: ФИНКИН ЭЛАУД, СОРТ КАРДС
Межпредметные связи: химия, биология, история.
Оборудование: таблицы «Галогены. Содержание галогенов в продуктах питания»,
«Окислительно-восстановительные уравнения», фарфоровые чашки,
пипетки, штативы с пробирками, держалки, стеклянные палочки,
фарфоровые пластинки, Периодическая таблица и таблицы
и карточки по Брайлю.
Вещества: образцы галогенов, иод кристаллический, природные минералы
галогенов, металлы (Na, Al), растворы: бромида, хлорида, иодида
калия (натрия), спиртовой р-р иода, нитрат серебра, раствор
крахмала, образцы пищевых продуктов: картофель, хлеб, мясной
фарш, ветчина, колбаса.
Ход урока.
-
Организационный момент: приветствие, проверка готовности к уроку, мотивация: положительный настрой к работе на уроке.
-
Актуализация знаний: визуальное знакомство с оборудованием и веществами, в связи с этим какова тема сегодняшнего урока? Что мы будем изучать?
Вывод темы урока на доске или слайде.
-
Повторение.Проблемный вопрос: Почему галогены - типичные неметаллы?(работа в парах)
а) положение галогенов в Периодической системе Д.И.Менделеева (устно)
б) составление электронных формул атомов фтора и хлора (письменно с пояснением)
в) решение окислительно-восстановительной реакции: 2Na + Cl2 = 2NaCl
на магнитной доске, повторение терминов: катион, анион, окисление, восстановление, окислитель, восстановитель.С использованием таблицы
« Окислительно-восстановительные уравнения»
г) объяснение ионной кристаллической решетки хлорида натрия.
Вывод делают дети: Соединения металлов и неметаллов имеют ионное строение.
-
Демонстрация взаимодействия порошкообразного алюминия с кристаллическим иодом с водой в качестве катализатора. Опыт проводится под тягой, можно провести демонстрацию по ссылке:
а) решение окислительно-восстановительного уравнения (каждый ученик -самостоятельно)
Вывод делают ученики: Галогены типичные неметаллы и сильные окислители.
-
Галогены по физическому состоянию (сообщение ученицы: приложение 1)
-
Путешествие в историю химии. Сообщение об открытии галогенов (приложение 2)
-
Физминутка ( Приложение 3)
-
Проведение качественных реакций на галоген-ионы: демонстрация взаимодействия солей галогенов с нитратом серебра ›
-
Реакции для определения качества продуктов: в продуктах, содержащих крахмал, происходит реакция со спиртовым раствором иода. Синее окрашивание указывает на присутствие в некачественных мясных продуктах крахмала.
-
Рефлексия: Что важного узнали на уроке?
Как изменилось ваше настроение?
-
Домашнее задание: 1) Составить кроссворд или презентацию по теме «Галогены»
2) Осуществить превращения по карточкам (Приложение 4)
Приложение 1
Физические свойства галогенов- простых веществ.
F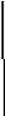 2 светло-желтый газ
2 светло-желтый газ
Cl2 желто-зеленый газ
Br2 красно-бурая жидкость
I2 темно- серые кристаллы
с металлическим блеском.
At2 черно-синие кристаллы.


1) Интенсивность цвета от фтора к астату усиливается.
-
Плотность простых веществ увеличивается ( в том же направлении)
-
Температуры плавления и кипения увеличиваются (от фтора к астату)
Приложение 2
Открытие галогенов
Фтор -от греч. «фторос» разрушающий, был открыт в 1866 году французским химиком Анри Муассаном электролизом смеси жидкого безводного фторида водорода и гидрофторида калия ( КНF2 ) в платиновом сосуде по уравнению
2HF → H2 (газ) + F2 (газ)
катод анод
В 1906 году Муассан был удостоен Нобелевской премии за открытие фтора и введение в практику электролиза.
Хлор - от греч. «хлорос» желто-зеленый, в 1774 году шведский аптекарь Карл Вильгельм Шееле писал: «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил её на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах.»
MnO2 + 4HCl → Cl2 + MnCl2 + 2 H2 O
Бром - от гоеч. «бромос» -«зловонный» открыт в 1826 году французским химиком (24-х летним лаборантом Антуаном - Жеромом Балларом. Он проводил действие хлора на рассолы соляных болот Франции по реакции:
2 NaBr + Cl2 -> 2 NaCl + Br2
Иод - от греч. «иодес» -фиолетовый открыт в 1811 году французским химиком - технологом и фармацевтом Бернаром Куртуа в золе морских водорослей, уравнение реакции: 2 NaI + H2 SO4 → Na2 SO4 + I2
Астат - от греч. «астатос» -неустойчивый. Был получен в 1940 году искусственным
путем при облучении висмута альфа-частицами учеными Калифорнийского университета Д.Корсоном и К.Р.Маккензи.
Приложение 3
Упражнения для развития межполушарного взаимодействия.
Физминутка
1.Восьмерки. Закройте глаза. Пальцами одной руки проведите перед глазами продольную восьмёрку. Следуйте закрытыми глазами за движениями пальцев. Продолжайте рисовать глазами, увеличивая размеры восьмёрки. Во время упражнения отдохните и откройте глаза. Проверьте резкость зрения.
2.Колечко.
Поочерёдно и как можно быстрее перебирайте пальцы рук, соединяя в кольцо с большим пальцем последовательно указательный, средний и т. д. Проба выполняется в прямом (от указательного пальца к мизинцу) и в обратном (от мизинца к указательному пальцу) порядке. В начале упражнение выполняется каждой рукой отдельно, затем вместе.
3. Качание головой. Дышите глубоко. Расправьте плечи, закройте глаза, опустите голову впереди медленно раскачивайте головой из стороны в сторону.
-
Рисующий слон. Встаньте или сядьте в позу слона. Колени слегка подогнуты. Наклонитесь головой к плечу. Вытяните руку вперёд и рисуйте ей то, что видите большими мазками. Затем повторите то же с другой рукой.
Приложение 4
Cl2 → HCl --> CuCl2 → ZnCl2 → AgCl
Литература:
-
Габриелян О.С. Химия, Учебник для общеобразовательных учреждений 9 класс, М. Дрофа, 2009;
-
Габриелян О.С., Остроумов И.Г. Настольная книга учителя, 9 класс, М.Дрофа, 2002;
-
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Учебник для общеобразовательный учреждений Химия 8 класс, М., Дрофа, 2008
-
Горковенко М.Ю. Поурочные разработки по химии, М., «Вако», 2013
-
Мастер-класс учителя химии 8-11 классы, М., «Планета», 2011
-
Интернетресурс ltarningapps.org/,
-
15-й Всероссийский интернет-педсовет.
-
›;