- Учителю
- Задания школьного тура Всероссийской олимпиады школьников по химии для 8 класса
Задания школьного тура Всероссийской олимпиады школьников по химии для 8 класса
Задания школьного этапа Всероссийской олимпиады школьников
для 8 класса.
Задание 1.
ТЕСТ Выберите один правильный ответ (1 балл за каждый ответ)
1. Сколько элементов, простые вещества которых неметаллы, представлены сегодня в периодической системе химических элементов Д..И. Менделеева?
1) 12, 2) 22, 3) 44, 4) 89.
2 . Какой элемент назван в честь небесного тела - спутника Земли:
1) Со - кобальт, 2) Те - теллур, 3) Sе - селен, 4) U - уран .
3.. Какой элемент назван в честь мифического героя, укравшего огонь у богов:
1) Та - тантал, 2) Тh - торий 3). Nb - ниобий, 4). Pm - прометий
4. К чистым веществам относится:
1) уксус, 2) дистиллированная вода, 3) воздух, 4) молоко.
5. Является веществом:
1) капля росы; 2) медная монета; 3) кусочек мела; 4) ртуть.
6.Одинаковую относительную молекулярную массу имеют вещества, формулы которых: 1)CuSO4 и CuS, 2) CuS и CuO, 3) CuO и Cu2S, 4) CuSO4 и Cu2S .
7.Массовая доля серы в серной кислоте H2S04 равна: 1. 2,04%. 2. 65,31%. 3. 32,65%. 4.3,2% .
8. Из списка условий протекания и признаков химической реакции
выберите признак химической реакции:
1) соприкосновение веществ, 2) образование нерастворимого вещества (осадка), 3) облучение светом, 4)) нагревание.
9. Укажите, где речь идёт о физическом явлении:
1)) твёрдый углекислый газ - « сухой лёд», превращается в газ, минуя жидкую фазу,
2) углекислый газ собирается на дне стакана и постепенно вытесняет находившийся там воздух,
3) углекислый газ и вода в процессе фотосинтеза образуют крахмал
4) углекислый газ вызывает помутнение известковой воды
10. Где по правилам техники безопасности нужно хранить концентрированные кислоты?
1) на лабораторных столах; 2)в металлическом ящике; 3) в прохладных помещения; 4) в вытяжных шкафах.
Задача№1.
В настоящий момент известно 118 химических элементов. Каждому из них присвоено символьное обозначение и дано название. В Периодической системе Д.И. Менделеева каждый элемент находится в отдельной ячейке. В предлагаемом Вашему вниманию кроссворде зашифрованы названия семи из них.
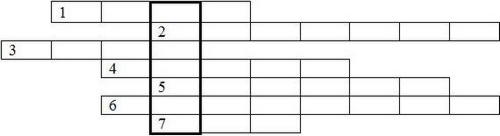
1. Простое вещество, образованное этим химическим элементом, представляет собой твердое, хрупкое вещество желтого цвета. Оно встречается в природе в самородном состоянии и известно человечеству с самых древних времен. Считалось, что голубое пламя и запах газов, образующихся при горении этого вещества, отгоняют демонов.
2. Этот элемент также известен с глубокой древности. Из него состоят несколько разных простых веществ, два из которых встречаются в природе: алмаз и графит. Все органические вещества содержат этот элемент в своем составе.
3. Из простого вещества, образованного этим элементом, в основном состоит земная атмосфера. Несмотря на это, при «крещении» элемент получил название «безжизненный». Калиевая соль одной из кислот, образуемых этим химическим элементом, входит в состав дымного пороха.
4. Впервые этот элемент был обнаружен не на Земле, а на Солнце спектральным анализом. При обычных условиях простое вещество представляет собой очень легкий негорючий газ, которым наполняют воздушные шары.
5. Один из самых распространенных в природе элементов (6 место по содержанию в земной коре). Будучи активнейшим металлом, в свободном состоянии в природе не встречается. Зато входит в состав обычной поваренной соли, которую мы едим каждый день.
6. На этот элемент приходится 47 % массы земной коры. Образуемое им газообразное простое вещество тоже входит в состав воздуха, но безжизненным этот элемент назвать уж точно нельзя. Интересно, что при сильном охлаждении этот бесцветный газ превращается в голубую жидкость.
7. В быту мы можем встретить этот элемент в коричневой водно-спиртовой настойке, которой обрабатывают небольшие порезы и раны. В природе его умеют накапливать некоторые виды морских водорослей, в частности, морская капуста. Простое вещество при обычных условиях представляет собой кристаллы черно-серого цвета с металлическим блеском. При нагревании превращается в красивые фиолетовые пары.
1. Разгадайте этот кроссворд. Ответы напишите в формате «номер - слово».
2. Какой элемент оказался зашифрован в вертикальном столбце? Объясните этимологию названия этого элемента. Напишите его символ и положение в периодической системе. Определите состав атомов этого химического элемента.
8 баллов.
Задача №2)
Существует несколько видов химических формул веществ. В частности, простейшая (она показывает, какие элементы, и в каком соотношении входят в состав вещества), молекулярная (показывает, какие элементы и в каком количестве входят в состав молекулы вещества), структурная (показывает, как атомы в молекуле связаны друг с другом). Азот образует несколько соединений с водородом. Известно, что в аммиаке содержится 82,35% азота и 17,65% водорода, а в гидразине 87,5% азота и 12,5% водорода (проценты везде массовые).
-
Определите простейшие формулы аммиака и гидразина.
-
Определите молекулярные формулы аммиака и гидразина, если известно, что количество атомов в молекуле аммиака соответствует его простейшей формуле, а в молекуле гидразина - в 2 раза больше числа атомов в простейшей формуле.
-
Какие это вещества - простые или сложные? Ответ объясните.
-
Составьте структурные формулы аммиака и гидразина.
-
Определите тип химических связей в каждом веществе.
15 баллов.
Задача №3.
3. Найдите массовую долю сульфата натрия в растворе, полученном добавлением 100г воды к 250г. 15% раствора соли.
(5 баллов
Система оценивания:
Тест:
-
2
3
4
2
4
4
3
2
1
4
За каждый правильный ответ 1 балл.
Итого 10 баллов.
Задача №1.
-
. 1-сера, 2- углерод, 3- азот, 4- гелий, 5 - натрий, 6 -кислород, 7 -йод.
Ключевое слово - рутений.
За каждое правильно угаданное слово - 1 балл.
За определение ключевого слова - 1 балл.
Итого - 8 баллов.
Задача №2.
1. За определение простейшей формулы аммиака - 3 балла,
За определение простейшей формулы гидразина - 3 балла,
2. За нахождение молекулярной формулы аммиака (NH3) - 1 балл,
За нахождение молекулярной формулы гидразина - N2H6 - 1б
3.За определение простые или сложные это вещества - 1 балл
4.за составление структурных формул аммиака и гидразина - 3 балла
5. За определение типа химической связи в данных веществах - 3 балла
Итого - 15 баллов.
Задача №3
Система оценивания:
1. За нахождение массы соли: 250* 0,15=37, 5г. 1ьалл
За нахождение массы раствора: 250+100=350г. 2 балла
За нахождением массовой доли сульфата натрия в растворе: ,1071 (10,71%) 2балла
5 баллов
Итого - 5 баллов.
Итого - 38 баллов.
.