- Учителю
- Урок химии 9 класс Тема:
Урок химии 9 класс Тема:












 Северо-Казахстанская область
Северо-Казахстанская область
Тайыншинский район
КГУ «Леонидовская СШ»
Учитель химии:
Закревская
Ирина Владимировна
Тема « Серная кислота и её соли»
Ход урока.
Организационный момент.
Приветствие учителя.
Проверка домашнего задания.
На интерактивную доску выводятся вопросы:
1.Элемент третьего периода шестой группы главной подгруппы.
(Сера)
2.Степени окисления, которые проявляет этот элемент в соединениях.
(-2,+4,+6)
3.Формула летучего водородного соединения данного элемента.
(H2S)
4.Записать химические формулы оксидов, которые образует данные элемент.
(SO2, SO3)
5.Образует ли кислоты данный элемент?
(да)
Ответы так же выводятся на интерактивную доску, причём учащиеся обмениваются листами ответов. Осуществляется взаимопроверка.
Изучение нового материала.
Класс делится на 2 группы. Каждой группе выдаётся лист ответа (Приложение 1).
Учитель:
Элемент, о котором мы говорили на предыдущих уроках - сера.
Сера - это неметалл, а неметаллы образуют кислоты.
Задание 1.
Запишите в своём листе ответов формулы кислот, которые образует сера и назовите их (сернистая кислота, серная кислота, сероводородная кислота).
Запишите уравнения химических реакций получения кислородосодержащих кислот.
SO2 + H2O=H2SO3
SO3 + H2O=H2SO4
Как вы думаете, какая из этих кислот имеет наибольшее практическое значение?
Предскажите тему нашего урока.
Запишите её в лист ответов.
Учитель проговаривает цели и задачи урока.
2. Физические свойства серной кислоты.
Серная кислота - тяжёлая бесцветная, маслянистая нелетучая жидкость. Плотность серной кислоты с массовой долей 96% составляет
1,84 г/см3 (плотность дистиллированной воды - 1 г/см3). При 280° серная кислота кипит, а при 10,4° - кристаллизуется.
Техника безопасности при работе с кислотой.
При растворении в воде серная кислота образует гидраты различного состава: H2SO4∙H2O, H2SO4∙2H2O, H2SO4∙4H2O - с выделением большого количества теплоты. Поэтому при разбавлении серной кислоты водой следует соблюдать правила техники безопасности.
Задание 2.1.Рассмотрите рисунок.
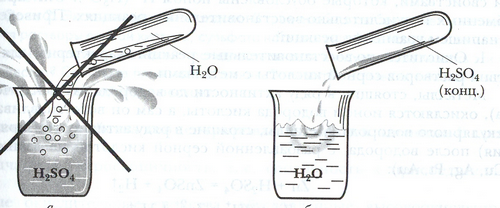
Прокомментируйте действия, необходимые при разбавлении кислоты водой.
Ответ запишите в лист ответа.
Концентрированная серная кислота - сильный окислитель. При попадании на кожу, бумагу, древесину и другие вещества кислота обугливает их (демонстрация обугливания сахара концентрированной серной кислотой на интерактивной доске). Разбавленная серная кислота так же опасна, поэтому работая с серной кислотой следует соблюдать осторожность не только при разбавлении кислоты, но и при работе с ней.
Задание 2.2. Работаем с раствором кислоты.
Предложите алгоритм действий оказания первой медицинской помощи при попадании раствора серной кислоты на кожу.
1._______________________________________________________________
2._______________________________________________________________
3._______________________________________________________________
4._______________________________________________________________
3. Химические свойства серной кислоты.
Концентрированная серная кислота - сильный окислитель. Она может взаимодействовать с такими пассивными металлами как медь и ртуть, при этом одним из продуктов реакции является диоксид серы.
Демонстрация взаимодействия концентрированной серной кислоты с медью (на интерактивной доске).
Cu + 2H2SO4= CuSO4 + SO2↑+ 2H2O
Задние 3.1.
Записать окислительно - восстановительную реакцию данного процесса.
Cu0 + 2H2S+6O4= Cu+2SO4 + S+4O2↑+ 2H2O
Cu0 -2е = Cu+2 2 1 - восстановитель
S+ 6 +2е= S+4 2 1 - окислитель
Разбавленная серная кислота.
Разбавленная серная кислота обладает общими свойствами, характерными для кислот.
Ознакомление с химическими свойствами серной кислоты сопровождается демонстрацией химических опытов учителем.
1.Серная кислота при растворении в воде диссоциирует на ионы. Диссоциация проходит ступенчато.
H2SO4 =H+ + HSO4-
HSO4- = H+ + SO42-
H2SO4+ HSO4-= H+ + HSO4-+ H+ + SO42-
H2SO4=2 H+ + SO42-
Изменяет цвет индикаторов:
-лакмус синий в красный цвет;
-метиловый оранжевый в розовый цвет,
-фенолфталеин - бесцветный.
2.Взаимодействует с основными и амфотерными оксидами.
3.Взаимодействует с металлами, стоящими в электрохимическом ряду напряжения металлов о водорода. При этом выделяется водород и образуется соль.
Zn0+ H2+SO4= Zn+2SO4+ H20 ↑
Zn0 - 2e = Zn+ 2 2 1- восстановитель
2H+ + 2e = + H20 ↑ 2 1- окислитель
4. Взаимодействует с основаниями.
Как называется реакция взаимодействия кислот с основаниями? (Реакция нейтрализации).
У доски работают два ученика.
Дописать молекулярное уравнение. Записать полное и сокращённое ионное уравнение.
1.
2NaOH + H2SO4=Na2SO4 + 2H2O
2Na+ + 2OH-+ 2H+ + SO42- = 2Na+ + SO42- +2H2O
2OH-+ 2H+ = 2H2O
2.
Ca(OH)2 + H2SO4= CaSO4 + 2H2O
Ca2+ + 2OH- +2H++ SO42-= Ca2+ + SO42- +2H2O
2OH- +2H = 2H2O
Задание 4.
Лабораторная работа.
«Качественная реакция на серную кислоту и её соли».
В трёх склянках находятся растворы серной кислоты, сульфата натрия, сульфата цинка. Пользуясь карточкой - инструкцией (Приложение 2.), проведите качественную реакцию на сульфат - ион.
5.Соли серной кислоты.
Серная кислота образует два вида солей - средние и кислые. Почему?
( потому что серная кислота - двухосновная).
Средние соли называются - сульфаты, кислые соли называются гидросульфаты.
Большинство сульфатов хорошо растворяются в воде. Многие сульфаты имеют практическое значение.
Na2SO4∙10H2O - сульфат натрия, кристаллогидрат. В природе встречается в виде минерала мирабилита. Применяется в медицине под названием глауберова соль.
FeSO4∙7 H2O - железный купорос. Применяется в фотографии, для окрашивания тканей, в борьбе с вредителями сельскохозяйственных культур.
Задание 5.Информацию о гипсе и медном купоросе учащиеся представляют в виде презентации (домашнее задание).
Применение серной кислоты.
Серная кислота имеет большое практическое значение.
Задание 6.
Проанализируйте схему на рисунке 15 стр.77.
Ответьте на вопросы.
Серную кислоту применяю как электролит в кислотных аккумуляторах.
да
нет
Серную кислоту используют как электролит в щелочных аккумуляторах.
да
нет
Серную кислоту используют в органическом синтезе.
да
нет
Серную кислоту используют в производстве лекарственных препаратов.
да
нет
Рефлексия. Заполни таблицу.
Это я знал
Об этом я думал иначе
Это для меня новое
Домашнее задание.
Прочитать §16. Задание 5 стр.78 (письменно).
Карточка-инструкция
к лабораторному опыту
«Качественная реакция на серную кислоту и её соли»
Цель опыта
Ход работы
Наблюдения
Объяснение наблюдений, выводы,реакции.
1.Провести качественную реакцию на серную кислоту.
1.В чистую пробирку налей 1 мл 2-%-ого раствора серной кислоты и прилей 5-6 капель 2-%-ого раствора хлорида бария.
1.В пробирке выпал_________
осадок.
1.Молекулярное, полное и сокращённое ионные уравнения.
1
2
3
Вывод: реактивом на серную кислоту являются растворимые соли __________, при этом выпадает__________ ___________ осадок.
2.Провести качественную реакцию на раствор сульфата натрия.
.
2. В чистую пробирку налей 1 мл 2%-ого раствора сульфата натрия и прилей 5-6 капель 2-%-ого раствора хлорида бария.
2. В пробирке выпал_________
осадок.
2. 1.Молекулярное, полное и сокращённое ионные уравнения.
1
2
3
Вывод: реактивом на серную кислоту являются растворимые соли __________, при этом выпадает__________ ___________ осадок.
Общий вывод: Реактивом на сульфат-ионы являются ионы _______________, при этом выпадает_______________
______________________ осадок.
Правила техники безопасности.
-
Все вещества бери в указанном количестве.
-
Если ты взял вещество в большем количестве, излишек не выливай в склянку с чистым вещество, а вылей в посуду для отходов.
-
Ты работаешь с серной кислотой. Работай с ней осторожно!
Береги своё здоровье и здоровье окружающих.
Карточка-инструкция
к лабораторному опыту
«Качественная реакция на сульфат -ион »
Цель опыта
Ход работы
Наблюдения
Объяснение наблюдений, выводы,реакции.
1.Провести качественную реакцию на серную кислоту.
1.В чистую пробирку налей немного 2-%-ого раствора серной кислоты и прилей немного 2-%-ого раствора хлорида бария.
1.В пробирке выпал_________
осадок.
1.Молекулярное, полное и сокращённое ионные уравнения.
1
2
3
Вывод: _________________________________
_________________________________
_________________________________
_________________________________
2.Провести качественную реакцию на раствор сульфата натрия.
.
2. В чистую пробирку налей немного 2%-ого раствора сульфата натрия и прилей немного 2-%-ого раствора хлорида бария.
2. В пробирке выпал_________
осадок.
2. 1.Молекулярное, полное и сокращённое ионные уравнения.
1
2
3
Вывод:
_________________________________
_________________________________
_________________________________
Общий вывод: Реактивом на _______________ являются ионы _______________, при этом выпадает_______________
______________________ осадок.
Правила техники безопасности.
-
Все вещества бери в не большом количестве. Экономь реактивы.
-
Если ты взял вещество в большем количестве, излишек не выливай в склянку с чистым вещество, а вылей в посуду для отходов.
-
Ты работаешь с серной кислотой. Работай с ней осторожно!
Береги своё здоровье и здоровье окружающих.