- Учителю
- Карты-инструкции к практическим работам для 9 класс
Карты-инструкции к практическим работам для 9 класс
Карты- инструкции
к практическим и лабораторным работам
для 9 класса
средней общеобразовательной школы
ученик________________________
с оставила учитель химии Наривончик Людмила Сергеевна
оставила учитель химии Наривончик Людмила Сергеевна
Свои способности человек может узнать, только применив их на деле.
Сенека.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА.
Главной педагогической задачей, стоящей перед лабораторными и практическими работами, является эксперементальный путь знакомства с составом вешеств, их химическими свойствами и применением. Для этого учащиеся должны обладать знаниями:
-
качественного ит количественного состава вещества;
-
условия протекания химических реакций;
-
какие опереции необходимы при этом;
-
как наблюдать и делать вывод.
Опыт работы в школе показал, что наиболее рациональным является путь, когда ознакомление учащихся с веществами и их химическими превращениями сопровождается постоянным формированием у них умений и навыков выпрлнения лабораторных операций, навыков наблюдения, формирование следствий и выводов. Постепенно накапливаются знания, которые необходимы для успешного и саостоятельного изучения новыхвеществ и их превращений.
Успех выполнения практической работы учащихся зависит от:
-
четкости формулировки цели и задачи;
-
знания операций, которые необходимо провести, их последовательности, приемов выполнения, мер предосторожности;
-
умения определить перечень необходимого оборудования;
-
знаний, как фиксировать наблюдения, оформить результат;
-
умения привести рабочее место в порядок.
Поэтому, наиболее приемлимым в своей работе, я считаю использование, составленных мною, карт-инструкций к проведению практических и лабораторных работ.
Целью этих инструкций, является, приближение учащихся к самостоятельности, разработке гипотез, поиску спосоьов проверки, использованию исследовательского подхода. Таким оьразом, постепенно, карты-инструкции превращеются в план проведения работы, и учащиеся могут её выполнять не имея при себе определенных инструкций.
Карты-инструкции составлены на основе учебника нового поколения Н. Нурахметова, К Сармановой, К. Джексембиной и др. "Химия 9" согласно программы.
Практическая работа №1 (1)
Тема: Экспериментальное решение задач по теме: «Теория электролитической диссоциации»
Цель: усовершенствовать практические навыки, полученные по данной теме.
Оборудование и реактивы: штатив с пробирками, держатели и нагревательные приборы для пробирок или спиртовка, установка для фильтрования, растворы соляной, серной кислот, гидроксида калия, карбоната калия, нитрата серебра, сульфата меди (П), хлорида кальция, хлорида железа (Ш); лакмус и фенолфталеин; твердый карбонат кальция (мел, мраморная крошка).
Рекомендации по соблюдению ТБ:
-
Будьте осторожны при работе с растворами кислот и щелочей
-
Не берите больше указанного в условиях количества вещества.
-
Помните, многие реактивы ядовиты. Не допускайте попадания реактивов на руки и одежду.
-
Не перепутайте крышки и пробки колб с реактивами.
С правилами ознакомлен: _____________________________________
Задача 1. Проведите реакции между растворами следующих веществ:
а) карбонат калия и соляная кислота;
б) хлорида железа (Ш) и гидроксида калия;
в) гидроксида калия и серная кислота;
Напишите уравнения реакций в молекулярном и ионном виде.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 2. Осуществите следующие превращения: сульфат меди (П) → гидроксид меди(П) → оксид меди(П) → хлорид меди(П)
Напишите уравнения реакций, укажите условия их протекания.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 3. Проведите реакцию нейтрализации в присутствии лакмуса (фенолфталеина)
Напишите полное и сокращенное ионное уравнения реакций. Объясните результаты наблюдения.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 4. Используя имеющиеся в наличии реактивы, получите: а) гидроксид железа (Ш); б) гидроксид меди(П). Выделите их из смеси.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 5. Используя имеющиеся в наличии реактивы, получите посредством реакций обмена газообразное вещество. Напишите уравнение реакции в молекулярном и ионном виде.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дополнительные задания.
Осуществите реакции, которые выражаются следующими ионными уравнениями:
а) H+ + OH- → H2O
б) Ag+ + Cl- → AgCl↓
в) Ba2+ + SO42- → BaSO4↓
г) Ca2+ + CO32-→ CaCO3↓
д) CO32- + 2H+ → CO2↑ + H2O
Напишите уравнения реакций в молекулярном и ионном виде.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа №1 (2)
Тема: Экспериментальное решение задач по теме: «Теория электролитической диссоциации»
Цель: усовершенствовать практические навыки, полученные по данной теме.
Рекомендации по соблюдению ТБ:
-
Будьте осторожны при работе с растворами кислот и щелочей
-
Не берите больше указанного в условиях количества вещества.
-
Помните, многие реактивы ядовиты. Не допускайте попадания реактивов на руки и одежду.
-
Не перепутайте крышки и пробки колб с реактивами.
С правилами ознакомлен: _____________________________________
Задание 1. Напишите уравнение реакции, идущей между растворами:
а) хлорида меди (П) и гидроксида калия;
б) карбоната натрия и азотной кислоты. Что наблюдаете? Напишите полное и сокращенное ионные уравнения проведенных реакций.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. Испытайте растворы солей индикатором. Выполните опыт.
Испытайте лакмусом следующие растворы:
-
хлорида натрия;
-
хлорида меди(П);
-
карбоната натрия.
Что наблюдаете? В водном растворе какой соли лакмус изменяет окраску?
Напишите формулы солей в соответствующие графы таблицы. Объясните, почему исследованные растворы солей показывают различные среды.
Кислая среда
Нейтральная среда
Щелочная среда
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 3. Напишите уравнение реакций между раствором соляной кислоты и металлического цинка. Что наблюдаете? Напишите полное и сокращенное ионные уравнения реакций.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 4. Используя имеющиеся на столе реактивы, получите гидроксид железа(Ш). Напишите полное и сокращенное ионные уравнения реакций.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте общий вывод по проделанной работе: ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторные опыты по теме
«Электролитическая диссоциация и свойства электролитов»
Опыт 1. Реакция обмена в растворах электролитов.
З а д а н и я: изучите условия протекания реакции обмена до конца; рассмотрите реакции, идущие с выделением газа, образованием воды и осадка; получите карбонат кальция или хлорид серебра из имеющихся реактивов.
О б о р у д о в а н и е и р е а к т и в ы: штатив с пробирками, таблица «Растворимость солей, кислот и оснований в воде», емкость для отходов; растворы гидроксидов натрия и кальция, соляной кислоты, серной кислоты, сульфата меди, карбонатов калия или натрия, хлорида кальция, нитрата серебра и фенолфталеина.
В ы п о л н е н и е о п ы т а:
1. Проведите реакции между растворами следующих веществ:
а) гидроксид натрия и сульфат меди (П);
б) карбонат калия и соляная кислота;
в) гидроксид натрия (в присутствии фенолфталеина) и серная кислота.
2. Составьте полные и сокращенные ионные уравнения реакций, сделайте вывод об условиях, в которых протекают эти реакции.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Из имеющихся реактивов получите возможными способами карбонат кальция. Составьте уравнения соответствующих реакций.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Проведите качественную реакцию на хлорид-ион.
__________________________________________________________________________________________________________________________________________________________
Практическая работа №2
Тема: Экспериментальное решение задач по теме: «Неметаллы»
Цель: усовершенствовать практические навыки, полученные по данной теме.
Оборудование и реактивы: растворы соляной кислоты, гидроксида натрия, карбоната натрия, сульфата аммония, натрия, нитрата бария, хлорида аммония; лакмус, фенолфталеин; карбонат калия, нитрат аммония, фосфат натрия; штатив с пробирками.
Рекомендации по соблюдению ТБ:
-
Будьте осторожны при работе с растворами кислот и щелочей
-
Не берите больше указанного в условиях количества вещества.
-
Помните, многие реактивы ядовиты. Не допускайте попадания реактивов на руки и одежду.
-
Не перепутайте крышки и пробки колб с реактивами.
С правилами ознакомлен: _____________________________________
Задача 1. Используя имеющиеся реактивы, практически осуществите превращения веществ по следующей схеме:
CuSO4 → Cu(OH)2→ CuCl2
Объясните, почему проведенные реакции идут до конца.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 2. В трех пробирках находятся растворы сульфата натрия, карбоната натрия (калия), хлорида аммония. Используя необходимые реактивы, распознайте каждый из растворов.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 3. Проведите качественную реакцию на сульфат аммония (NH4)2SO4.
__________________________________________________________________________________________________________________________________________________________
Задача 4. Используя необходимые реактивы, осуществите реакции по следующим схемам:
а) CO32- + 2H+ = H2O + CO2 ↑ б) Cu2+ + 2OH- = Cu(OH)2 ↓
в) Ca2+ + CO32- = CaCO3↓
Укажите условия протекания реакций до конца. Запишите уравнения химических реакций в молекулярной и ионной формах.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дополнительные задания.
-
В двух склянках без этикеток находятся растворы солей сульфата меди (П) и силиката натрия. Какие качественные реакции нужно провести , чтобы определить опытным путем вид соли в каждой из склянок?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
В лаборатории имеются реактивы: а) раствор гидроксида калия; б)твердый карбонат натрия; в) раствор азотной кислоты; г) раствор хлорида меди(П). Какие вещества можно получить из этих реактивов? Какие вещества будут в большем количестве? Составьте уравнения реакций в молекулярном и сокращенном ионном виде. Отметьте признаки реакций.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторные опыты по теме «Неметаллы»
Распознавание серной кислоты и её солей.
Опыт 1. Определение сульфат-ионов в растворах.
О б о р у д о в а н и е и р е а к т и в ы: растворы хлорида бария, сульфата натрия, серной кислоты(разб); метилоранж, лакмус; штатив с пробирками.
В ы п о л н е н и е о п ы т а:
1. В две пробирки налейте по 2-3 мл растворов серной кислоты и сульфата натрия.
2. В каждую пробирку добавьте раствор хлорида бария.
3. Что наблюдаете? Напишите уравнения соответствующих реакций.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 2. Распознавание карбонатов. Получение углекислого газа и опыты с ним.
О б о р у д о в а н и е и р е а к т и в ы: прибор для получения углекислого газа; кусочки мрамора, соляная кислота, известковая вода; растворы карбоната натрия, фенолфталеина, лакмуса; штатив с пробирками.
Выполнение опыта 1.:
-
Проведите качественную реакцию на карбонаты. В пробирку налейте 2-3 мл раствора карбоната натрия и добавьте несколько капель соляной кислоты.
-
Что наблюдаете?
-
Сделайте вывод о способе обнаружения карбонатов. Напишите уравнения реакций в ионном виде.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение опыта 2.:
-
Получите диоксид углерода, проведите характерные для него реакции. Подготовьте заранее две пробирки: одну - с 2 мл раствора лакмуса в дистиллированной воде, другую - с 2-3 мл известковой воды с добавлением фенолфталеина.
-
С
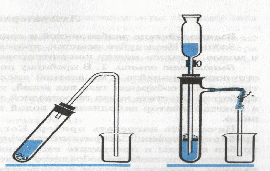
оберите прибор для получения газа.
В пробирку поместите несколько кусочков мрамора. Налейте столько соляной кислоты, чтобы она покрывала кусочки мрамора, и закройте пробку с газоотводной трубкой, конец которой направьте вниз.
-
Сделайте вывод о способе получения углекислого газа. Напишите уравнение реакции. ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Конец газоотводной трубки погрузите в пробирку с раствором лакмуса так, чтобы конец трубки оказался ниже уровня раствора. Пропускайте диоксид углерода до тех пор, пока окраска индикатора не изменится на розовый цвет.
-
проделайте аналогичный опыт с известковой водой, пропустив газ до выпадения осадка. Продолжайте пропускать газ до исчезновения осадка.
-
Напишите уравнения соответствующих реакций. Сделайте соответствующие выводы о проделанной работе.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторные опыты по теме «Металлы».
Опыт 1. Ознакомление с образцами металлов.
З а д а н и е.: изучите физические свойства выданных образцов металлов; недостающие данные возьмите из справочной литературы.
О б о р у д о в а н и е: коллекция металлов, магнит.
В ы п о л н е н и е о п ы т а:
-
Рассмотрите образцы металлов.
-
Исследуйте действие магнита, относительную твердость металлов.
-
Результаты исследований занесите в таблицу «Физические свойства металлов»:
Физические свойства металлов
Металл
Цвет
Твердость
Действие магнита
Плотность
Температура плавления
Электропроводность
? 1. Какие физические свойства металлов являются общими?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Какие индивидуальные особенности металлов вы обнаружили?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Какие свойства определяют применение рассмотренных вами металлов?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
*Опыт 2. Взаимодействие металлов с растворами кислот и солей.
З а д а н и е.: изучите на опытах химические свойства металлов; на основании результатов опытов объясните принцип разложения элементов в электрохимическом ряду напряжения металлов.
О б о р у д о в а н и е и р е к т и в ы: штатив с пробирками; цинк (гранулы), медь (проволока), растворы соляной кислоты, хлорида цинка, хлорида меди (П), сульфата (хлорида) железа(П)
В ы п о л н е н и е о п ы т а:
1. В три пробирки налейте по 1 мл раствора соляной кислоты и опустите в каждую пробирку по кусочку различных металлов (Zn, Fe, Cu). В каких случаях протекают химические реакции?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
? 2. Такой же эксперимент проделайте с раствором серной кислоты.
3. Запишите результаты опытов в таблицу «Взаимодействие металлов с кислотами»:
«Взаимодействие металлов с кислотами»
Металл
HCl
H2SO4
Zn
Fe
Cu
4. В пробирки налейте по 1 мл растворов каждой из выданных вам солей. Опустите в пробирки по одной грануле цинка.
-
Аналогичные опыты проделайте с железом и медью.
-
Укажите, с какими растворами солей вступили в реакцию цинк, железо, медь:
Металл
ZnCl2
FeSO4
CuCl2
Zn
Fe
Cu
? 1. Почему реакции произошли во всех пробирках?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Составьте уравнения наблюдаемых реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
3. Основываясь на результатах опытов, объясните закономерности электрохимического ряда напряжений металлов.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Ознакомление с образцами природных соединений кальция, алюминия и руд железа.
З а д а н и е.: ознакомьтесь с образцами выданных вам природных соединений; недостающие сведения найдите в учебной и справочной литературе.
О б о р у д о в а н и е : коллекция «Минералы и горные породы», «Природные соединения кальция», «Алюминий», «Чугун и сталь».
В ы п о л н е н и е о п ы т а:
Рассмотрите выданные образцы и заполните таблицу:
Название
Формула
Внешний вид
Местонахождение в Казахстане
Применение
? 1. Какие соединения рассматриваемого элемента наиболее распространены в природе?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Какие руды выгоднее использовать для получения данного металла в промышленности? Почему?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
3. Запишите уравнения химических реакций, которые можно использовать для получения металлов из этих руд.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Ознакомление с образцами алюминия и его сплавов.
З а д а н и е.: ознакомьтесь с образцами алюминия и его сплавов; сравните их свойства, недостающие сведения найдите в справочной литературе; установите связь между свойствами и областями применения сплавов алюминия.
О б о р у д о в а н и е: коллекция «Алюминий».
В ы п о л н е н и е о п ы т а:
-
Рассмотрите выданные образцы, сравните их твердость, пластичность.
-
Полученные данные занесите в таблицу:
Алюминий и его сплавы
Элементарный состав сплава
Внешний вид
Тпл
Твер
дость
Плот
ность
Применение
? 1. Почему в технике и в быту чаще используют сплавы алюминия, а не чистый алюминий?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Почему сплавы имеют различные свойства?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
3. На каких свойствах основано применение алюминия в пищевой промышленности?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Чем объясняется широкое применение сплавов алюминия в авиации, машиностроении, строительстве Приведите примеры.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 5. Взаимодействие гидроксида алюминия с растворами кислот и щелочей.
З а д а н и е.: получите гидроксид алюминия и исследуйте его характерные химические свойства.
О б о р у д о в а н и е и р е к т и в ы: штатив с пробирками; растворы соли алюминия, гидроксида натрия, соляной кислоты.
В ы п о л н е н и е о п ы т а:
-
В пробирку налейте 2 мл раствора соли алюминия и по каплям добавляйте раствор щелочи до образования студенистого осадка; рассмотрите образовавшийся гидроксид алюминия.
-
Половину осадка отлейте в другую пробирку.
-
К одной части осадка добавьте немного раствора кислоты до полного растворения.
-
К другой части приливайте раствор щелочи, встряхивая пробирку до тех пор, пока осадок не раствориться.
? 1. Какие химические реакции произошли в каждом опыте? Запишите уравнения в молекулярном и ионном виде.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Почему необходимо соблюдать рекомендованный порядок приливания реактивов друг к другу? Что произойдет, если в пробирку налить раствор щелочи, а затем по каплям добавлять раствор соли алюминия?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
3. Какой вывод можно сделать о характере химических свойств гидроксида алюминия?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 6. Ознакомление с образцами чугуна и стали.
З а д а н и е.: сравните выданные вам образцы чугуна и стали; дайте краткую характеристику.
О б о р у д о в а н и е : коллекция «Чугун и сталь»; магний.
В ы п о л н е н и е о п ы т а:
-
Рассмотрите образцы, исследуйте их цвет, твердость, способность притягиваться магнитом, коррозийную стойкость.
-
Сведения о сплавах железа запишите в таблицу:
Название сплава
Состав
Свойства
Применение
? 1. Почему в промышленности применяют сплавы железа?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Какие сплавы железа применяются чаще? Почему?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
3. Назовите отличительные свойства чугуна и стали. Сделайте вывод.
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа №3.
Тема: Решение экспериментальных задач по разделу «Металлы»
Цель: усовершенствовать практические навыки, полученные по данной теме.
Рекомендации по соблюдению ТБ:
-
Будьте осторожны при работе с растворами кислот и щелочей
-
Не берите больше указанного в условиях количества вещества.
-
Помните, многие реактивы ядовиты. Не допускайте попадания реактивов на руки и одежду.
-
Не перепутайте крышки и пробки колб с реактивами.
С правилами ознакомлен: _____________________________________
О б о р у д о в а н и е и р е к т и в ы: штатив с пробирками; реактивы в соответствии с содержанием задач каждого варианта.
Вариант 1.
-
Определите, в какой пробирке находится раствор каждой из солей: хлорида железа (Ш), хлорида алюминия, хлорида кальция.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Определите, в какой из пробирок находится раствор каждой соли: сульфата железа(П), сульфата натрия, сульфата алюминия.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Из оксида кальция получите хлорид кальция с помощью процессов, которые можно осуществить опытным путем:
СаО→Ca(OH)2→ CaCl2
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вариант 2.
1. С помощью одного реактива распознайте растворы хлорида железа (Ш), хлорида алюминия, хлорида калия.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Распознайте, в какой пробирке находятся растворы хлорида железа(Ш), сульфата натрия, сульфата алюминия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Проведите реакции, с помощью которых можно осуществить следующие превращения:
Ca(OH)2→ СаСО3 → Са(НСО3)2 → СаСО3
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дополнительные задания:
1) Получите тремя способами:
а) хлорид железа (Ш);
б) хлорид меди (П);
в) нитрат алюминия.
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2) Укажите, с какими веществами реагирует разбавленная серная кислота:
Cu, Al, NaCl, Cu(OH)2, ZnO, NaOH, Na2CO3.
Проделайте практические осуществите реакции.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3) С какими веществами будет взаимодействовать раствор гидроксида натрия: Al, MgSO4, Cu(OH)2, CO2, CaCO3, Ca(OH)2, H3PO4 ?
Проделайте практически осуществимые реакции.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
В лаборатории имеются реактивы:
а) раствор гидроксида калия;
б) твердый карбонат натрия;
в) раствор азотной кислоты;
г) концентрированная серная кислота;
д) раствор хлорида меди (П);
е) медь.
Сколько новых веществ можно получить. Используя только эти реактивы? Запишите уравнения возможных реакций.
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторные опыты по теме «Органические вещества».
Опыт 1. Изготовление моделей молекул углеводородов.
О б о р у д о в а н и е: разноцветный пластилин, спички (палочки или проволока)
Изготовление модели молекулы метана:
В ы п о л н е н и е о п ы т а:
1. Из белого или голубого пластилина (или из другого материала) сделайте четыре небольших шарика, имитирующих атомы водорода.
2. Сделайте еще один шарик черного цвета большего размера (имитация атома углерода).
3. На черном шарике наметьте четыре равноудаленных друг от друга небольших отверстия и вставьте в них спички (палочки), к свободным концам которых прикреплены маленькие белые (голубые) шарики - атомы водорода.
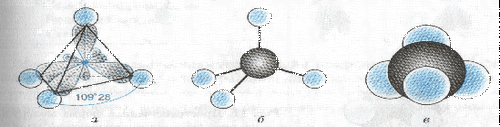
Пространственная форма мллекулы метана (а), его шаростержневая (б) и масштабная (в) модели
Изготовление модели молекулы этилена:
В ы п о л н е н и е о п ы т а:
1. Из белого или голубого пластилина (или из другого материала) сделайте четыре небольших шарика, имитирующих атомы водорода.
2. Сделайте еще два шарик черного цвета большего размера (имитация атома углерода).
3. На каждом черном шарике проделайте три небольших углубления, равноудаленных друг от друга примерно на 1200.
4. Внимательно рассмотрите рисунок , прикрепите к черным шарикам атомы водорода и соедините черные шарики стержнями из проволоки так, чтобы получилась модель молекулы этилена.
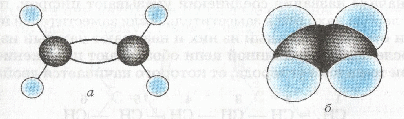
Шаростержневая (а) и масштабная (б) модели этилена
Опыт 2. Ознакомление с нефтепродуктами.
З а д а н и е.: ознакомьтесь с коллекцией «Нефть и нефтепродукты» и заполните таблицу:
Наименование продукта
Агрегатное состояние
Цвет
Применение
Вывод: _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Исследование свойств уксусной кислоты.
З а д а н и е.: ознакомьтесь со свойствами уксусной кислоты и докажите их аналогичность свойствам неорганических кислот.
О б о р у д о в а н и е и р е а к т и в ы: штатив с пробирками; растворы уксусной кислоты и щелочи; универсальный индикатор или синий лакмус; гранулы (порошок) цинка или магния, карбонат натрия (кальция).
В ы п о л н е н и е о п ы т а:
-
Возьмите три пробирки и в каждую налейте по 1-2 мл разбавленной уксусной кислоты. Обратите внимание на цвет растворов уксусной кислоты. Определите запах, соблюдая меры предосторожности.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
В первую пробирку добавьте несколько капель раствора индикатора (проверьте индикаторной бумагой). Что наблюдаете?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
В раствор уксусной кислоты во второй пробирке поместите кусочек (или добавьте порошок) цинка (магния). Если реакция идет медленно, пробирку можно подогреть.
-
В раствор уксусной кислоты в третьей пробирке поместите кусочки мела (или добавьте порошок карбоната натрия) и понаблюдайте за выделением газа.
-
Заполните таблицу, объясните все наблюдения, напишите уравнения соответствующих реакций в молекулярном и ионном виде:
Свойства и реактивы
СН3СООН
Физические свойства
Действие на индикаторы
Взаимодействие с Zn или Mg
Взаимодействие с Na2CO3 (или СaCO3)
? 1. Какие свойства уксусной кислоты аналогичны свойствам неорганических кислот?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. К какой группе кислот - сильной, слабой силы - относится уксусная кислота?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
Опыт 4. Сравнение растворимости мыла и синтетических моющих средств в воде.
З а д а н и е.: ознакомьтесь и сравните растворимость мыла и синтетических моющих средств в воде..
О б о р у д о в а н и е и р е а к т и в ы: мыльные стружки, синтетический моющий порошок, водопроводная (колодезная) вода, стаканы или пробирки, стеклянные палочки, индикатор.
В ы п о л н е н и е о п ы т а:
-
В два стакана (или пробирки) налейте по 3-5 мл водопроводной (колодезной) воды.
-
В один стакан добавьте небольшое количество мыльных стружек, в другой - моющего порошка.
-
Полученные смеси перемешайте стеклянной палочкой.
-
Среду растворов проверяйте индикатором.
Объясните происходящие явления.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
11