- Учителю
- урок по химии: 'Водород (8 класс) '
урок по химии: 'Водород (8 класс) '
Открытый урок химии по теме: "Водород. Химический элемент и простое вещество"
Тема: Водород. Химический элемент и простое вещество.
Цель: Дать представление о методе получения и собирания водорода и о малой плотности водорода - самый легкий газ. Вводимое понятие - гидриды, закрепление понятия валентность.
Методы: Урок- объяснение нового материала, лабораторные опыты.
Оборудование: аппарат Кипа, прибор для собирания газа демонстрационный, спиртовка, мыльный раствор, лучинка.
На лабораторных столах учащихся: соляная кислота ( р-р 1:2) и цинк в гранулах, прибор для получения газов.
План урока:
-
Водород в природе.
-
Водород, как химический элемент.
-
Водород - простое вещество.
-
Физические свойства водорода.
-
Получение и собирание водорода.
-
Применение водорода.
Ход урока:
1. Организационный момент:
Мы с вами живем в ХХ 1 веке, в веке передовых технологий, компьютеров и реактивных самолетов. А как вы думаете, сколько тайн скрывает от нас природа, а сколько их было много, много, много лет назад? Давайте посмотрим на девиз нашего урока, о чем он нас предупреждает? -э то тоже пока для вас тайна, которая будет раскрыта к концу нашего урока. А поможет нам в этом знания о новом химическом элементе под названием -
водород.
2. Изучение нового материала:
Запишите тему урока с классной доски в тетрадь и посмотрите на план нашего урока.
Водород в природе .
Водород - самый распространенный элемент в космосе. Основная масса звезд состоит из водорода: Юпитер, Сатурн - 92% Н, 8 % Н е, 0,1 % все остальные химические элементы; водород преимущественно составляет межзвездное вещество. Водород входит в состав основного вещества Земли - воды. Если посмотреть на схему распространения химических элементов, то можно увидеть, что доля водорода в земной коре составляет около 1% ее массы ().
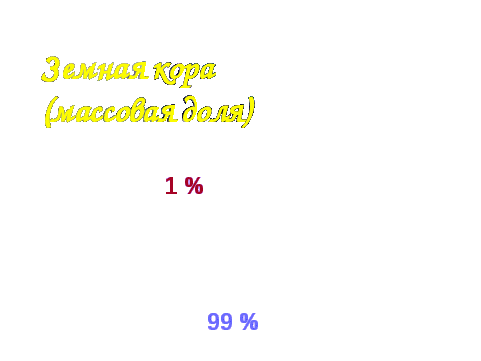 Однако , роль его в природе определяется не массой, а числом атомов, доля которых составляет около 17% (). Множество органических веществ представляют собой соединения водорода с углеродом - нефть, природный газ метан СН 4 и другие органические вещества.
Однако , роль его в природе определяется не массой, а числом атомов, доля которых составляет около 17% (). Множество органических веществ представляют собой соединения водорода с углеродом - нефть, природный газ метан СН 4 и другие органические вещества.
Водород как химический элемент .
Водород - первый химический элемент периодической системы химических элементов Д.И. Менделеева. Атомный номер водорода - 1, относительная атомная масса равна 1,0079. В 1766 году известный английский ученый Генри Кавендиш получил «искусственный воздух» действием цинка, железа или олова на разведенную соляную или серную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название «горючего воздуха». Но лишь в 1787 году Лавуазье доказал, что этот «воздух» входит в состав воды и дал ему название « гидрогениум», т. е. «рождающий воду», «водород».
Записали в тетради: Водород - химический элемент.
-
Н - название водород, гидрогениум.( Hydrogenium ).
-
Валентность = 1 (Вопрос классу - что такое валентность?).
-
Аr (Н) = 1.
-
Самый первый и самый легкий элемент.
-
Соединения он образует с большинством химических элементов. Названия соединений водорода с неметаллами включают в себя название неметалла и слово «водород» ( HCl - хлороводород , HI - йодоводород , H2S - сероводород.
Названия трех веществ вам следует запомнить, запишите:
H2O - вода, NH3 - аммиак, CH4 - природный газ метан.
Соединения водорода с металлами называют гидридами:
NaH - гидрид натрия, AlH3 - гидрид алюминия, TiH2 - гидрид титана.
Водород как простое вещество.
Записали в тетради: Водород - простое вещество. (формула - Н2 ).
Что показывает эта формула? (разбор формулы с учащимися по схеме):
-
название вещества - водород.
-
Тип вещества - простое . ( п очему? - ответы учащихся) .
-
Mr (Н2 ) = 2, что это показывает? - ответы учащихся, это показывает, что молекула водорода в два раза тяжелее 1/12 атомной массы углерода. Устные задачи: Какова масса одного моля водорода? - масса одного моль водорода равна 2 г , а чему равен объем одного моль водорода? Объем одного моль водорода равен 22,4 л , а объем двух моль водорода? Объем двух моль водорода = 44,8 л . Чему равен объем 20 г водорода? Сколько это будет моль? - 10 моль, а сколько литров - 224 л .
-
Графическая формула Н-Н. Почему? Так как валентность = 1, поэтому молекула водорода двухатомная.
-
Массовые доли элементов 100%.
-
Физические свойства ( при обычных условиях):
Агрегатное состояние: цвет, запах, вкус, плотность, растворимость в воде,
температура плавления, температура кипения, теплопроводность.
Заполняется учащимися самостоятельно, пользуясь наблюдениями при проведении лабораторного опыта и материалом из учебника или с помощью учителя).
7. Получение водорода:
Из чего проще получить - из воздуха, но там нет водорода, тогда из воды (Н 2 О). Действительно в промышленности получают водород из воды действием тока, идет реакция разложения воды с образованием двух веществ: водорода и кислорода. А из каких вообще веществ можно получать водород? Из тех, которые содержат химический элемент водород (Н). В лаборатории для получения водорода используют вещества, относящиеся к классу кислот. Например: HCl - хлороводород - соляная кислота. Как извлечь из нее водород? Провести реакцию замещения с металлом - Zn
HCl + Zn --- H2 + ?

Лабораторные опыты учащихся :
В пробирку налить 3 мл HCl и положить гранулу Zn , что наблюдаем? Выделяется газ - это водород. Какими свойствами он обладает?
Записать физические свойства водорода: газ, без цвета, без запаха, без вкуса, практически нерастворим в воде. Учитель добавляет, что водород почти в 15 раз легче воздуха (самый легкий из всех газов); имеет низкую температуру плавления (- 259 градусов) и низкую температуру кипения (-253 градуса); обладает хорошей теплопроводностью.
Реакция получения водорода в лаборатории проводится в аппарате Кипа или ему подобных . В одно из отделений закладывается Zn , а в другое наливается кислота, газ выходит по газоотводной трубке. Для получения небольших количеств используют прибор для получения газов меньшего размера, но действие его такое же.
Демонстрация учителя: существует два способа собирания водорода.
-
Собирание водорода методом вытеснения воды.
-
Собирание водорода методом вытеснения воздуха.
Полученный тем или иным способом водород может быть загрязнен воздухом с которым может образовывать взрывчатую смесь, это опасно! Вспомните девиз нашего урока. Поэтому полученный водород проверяют на чистоту.
Демонстрация учителя:
Наполняем пробирку водородом, используя один из методов собирания, и подносим ее открытым концом к пламени - если услышим хлопок со свистом, то водород загрязнен, если же хлопок глухой - то водород чистый.
8. Применение водорода :
Обусловлено его физическими и химическими свойствами. Физические свойства водорода имеют место применения в следующих областях:
Из-за того, что он легче воздуха им долгое время наполняли аэростаты, воздушные шары и дирижабли.

Демонстрация учителя : заполнение водородом мыльных пузырей . ( в газоотводную трубку аппарата Киппа вставлена воронка, а для того, чтобы мыльные пузыри не лопались добавляем в мыльный раствор немного глицерина).
Учитель или учащиеся, заранее приготовившиеся, рассказывают исторический очерк о применении водорода.
Братья - французы Монгольфье первые осуществили идею подняться на воздушном шаре, наполненном горячим воздухом. В 1783 году совершил полет на воздушном шаре, наполненном водородом французский физик Ж.Шарль. В 1794 году воздушные шары нашли практическое применение в военном деле. В последствии стали применять смесь водорода с гелием. Это было более безопасно, так как водородные шары часто воспламенялись. С 1932 по 1937 год немецкий дирижабль «Граф Цеппелин» совершил 136 полетов из Европы в Южную Америку и 7 полетов - в США и перевез свыше 13 тысяч человек. Потом дирижабли были постепенно вытеснены успехами авиации и вертолетостроения. Сейчас вновь обсуждаются вопросы создания современных дирижаблей. Другое универсальное свойство водорода - самая высокая теплопроводность среди всех газов - находит применение в современной энергетике для охлаждения электрических машин.
На следующем уроке мы с вами изучим химические свойства водорода и узнаем, где еще используется водород.
3. Подведем итог нашего урока : мы познакомились со вторым после кислорода элементом в химии - это водород.
Вы узнали его свойства и уникальность. Я думаю, вам понятно, почему надо обращаться с газом очень осторожно. Возможен взрыв, вот почему вы должны быть всегда начеку!

Оценки за урок и установка на материал следующего урока.
Мартукская средняя школа №1
Открытый урок химии по теме: "Водород. Химический элемент и простое вещество"
в 8 классе
учитель:
Цимерман С.Р.
2012-2013уч.г.