- Учителю
- Разработка урока по химии на тему Карбоновые кислоты
Разработка урока по химии на тему Карбоновые кислоты
Цели: Формирование системы знаний и общих компетенций, связанных с исследованием строения и свойств карбоновых кислот.
Образовательные: систематизировать сведения об общих химических свойствах кислот; на основе знаний о составе и строении карбоновых кислот научиться предсказывать их химические свойства, изучить некоторые специфические свойства отдельных кислот. рассмотреть общие свойства карбоновых кислот в сравнении со свойствами минеральных кислот.
Развивающие: развивать умения проведения исследовательской работы; совершенствовать специальные навыки и умения работать с химическими реактивами, записывать уравнения химических реакций; развивать интеллектуальные умения - выделять главное, наблюдать, делать выводы, сравнивать; использовать ранее накопленные знания по химии в контексте нового материала, расширить научную лексику путем введения в активный словарь новых терминов, продолжить формирование умений оформлять результаты своей работы и делать обобщения на основании полученных результатов;
Воспитательные: приучать к аккуратной работе в тетради, работе с реактивами с соблюдением ТБ, воспитывать коммуникативные способности, взаимовыручку, критически относится к оценке своих знаний:формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую мотивацию к изучению химии на основании положительного эмоционального восприятия предмета.
Цели исследовательской работы:
Сделать вывод о химических свойствах карбоновых кислот на основе проведенных исследований.
Тип урока: изучение нового материала.
Форма урока: урок с использованием элементов исследовательской деятельности, компьютерной презентации.
Формы работы: парная и индивидуальная.
Материалы и оборудование:
- химреактивы на столах учащихся: растворы соляной и уксусной кислот, раствор сульфата меди (II), порошок оксида магния, метиловый оранжевый, гидроксид натрия, раствор карбоната натрия, магний, пробирки;
- компьюторы, проектор, мультимедийная презентация.
Ход урока.
«Ум заключается не только в знаниях,
но и в умении применять знания в деле…»
Аристотель.
Вам уже известны общие физические свойства карбоновых кислот, знаете вы и строение функциональной группы, номенклатуру кислородосодержащих соединений. А хорошо ли вам знакомы отдельные представители этого класса соединений?
1 задание «Черный ящик» слайд 2.
-
У меня в ящике находится удивительное, но хорошо вам знакомое вещество. Название этого вещества древними греками отождествлялось с самим представлением о кислом. Нам оно хорошо известно в жидком агрегатном состоянии, но при охлаждении ниже 170С превращается в бесцветные кристаллы, похожие на лед. (уксусная кислота)
-
В ящике находится вещество, которым богаты плоды цитрусовых. В мякоти апельсина его около 2 %, в лимоне - 6 %. Впервые было выделено в 1784 году К. Шееле. (лимонная кислота)
-
Это вещество впервые было получено алхимиком Агриколой, который наблюдал при прокаливании янтаря похожий на соль белый налет этого вещества; используется в медицине. (янтарная кислота)
Учитель: Янтарная кислота - настоящий подарок для нас. Это естественное вещество, которое присутствует в организме, вырабатывается им. При приеме внутрь не вызывает привыкания и особых побочных эффектов, укрепляет иммунитет, усиливает клеточное дыхание, способствует усвоению кислорода клетками.
Правильно! Мы рассматривали тему «Карбоновые кислоты». Давайте повторим, что мы знаем о карбоновых кислотах.
2. Мини - разминка. Слайд № 3.
-
К какому классу кислородосодержащих органических соединений относятся эти вещества?
-
Как называется функциональная группа, содержащаяся в этих соединениях?
-
Как вы думаете, какие свойства продемонстрированных кислот мы еще не рассматривали?
-
Как вы думаете, сходны ли по химическим свойствам органические и минеральные кислоты? И почему?
Итак, тема нашего урока «Химические свойства и получение карбоновых кислот» Слайд № 4.
Далее работа в малых группах Класс разбит на 3 группы, у каждой группы свое исследование. В результате работы учащиеся должны ответить на вопрос: Слайд № 5
Принадлежат ли карбоновые кислоты к классу кислот?
Задание 1 группе. Слайд № 6
Взаимодействие уксусной и соляной кислот с металлами, стоящими в ряду напряжений до водорода и действие на индикатор.
Опыт 1. В две пробирки налить 2 - 3 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую пробирку внесите полоску индикатора метилового оранжевого (отметьте цвет индикатора). Во вторую пробирку добавьте порошка магния.
-
Опыт 2. В две пробирки налейте 2 - 3 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с минеральными кислотами). В первую пробирку добавьте полоску метилового оранжевого (отметьте цвет индикатора). Во вторую пробирку добавьте немного порошка магния.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций. Результатом работы являются наблюдения, оформленные в виде таблицы.
Результаты работы 1 группы. Слайд № 9
Вещество
№
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие с метиловым оранжевым
Индикатор окрасился в красно - розовый цвет
-
Взаимодействие с магнием
Выделение газа
2CH3COOH + Mg = Mg(CH3COOH)2 + H2
ацетат магния
2Н+ + Мg = Mg2+ + H2
Соляная кислота
2
Взаимодействие с метиловым оранжевым
Индикатор окрасился в красно - розовый цвет
-
Взаимодействие с магнием
Выделение газа
2 HCl + Mg = MgCl2 + H2
хлорид магния
2H+ + Mg = Mg2+ + H2
Вывод: Карбоновые кислоты взаимодействуют с металлами, стоящими в ряду активности до водорода
Задание группе № 2. Слайд № 7.
Взаимодействие уксусной и соляной кислот
с оксидами металлов и основаниями
Опыт 1. В две пробирки налейте по 2 - 3 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую пробирку внести немного порошка оксида меди и подогреть. Отметить изменение цвета содержимого. Во вторую пробирку внести полоску метилового оранжевого (отметить изменение цвета индикатора), затем нейтрализуйте кислоту раствором щелочи гидроксида калия.
Опыт 2. В две пробирки налейте 2 - 3 мл раствора соляной кислоты (помните о правилах
работы с минеральными кислотами). В первую пробирку добавьте немного порошка
оксида меди и слегка подогрейте. Отметьте изменение цвета содержимого пробирки. Во
вторую пробирку внесите полоску метилового оранжевого, отметьте изменение цвета
индикатора, затем нейтрализуйте кислоту раствором щелочи гидроксида калия.
Отметьте, какие изменения произошли. Сделайте соответствующие выводы. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы.
Результаты работы группы № 2. Слайд № 10.
Вещество
№
Опыта
Действие
Наблюдения
Уравнение реакции
Уксусная кислота
1
Взаимодействие с оксидом меди (2+)
После нагревания содержимое пробирки окрасилось в голубой цвет
CuO + 2CH3COOH = Cu(CH3COOH)2 + H2O
ацетат меди (2+)
CuO + 2H+ = Cu2+ + H2O
Взаимодействие с раствором щелочи
Метиловый оранжевый в кислой среде окрасился в красно - розовый цвет, который при добавлении гидроксида калия исчезает
CH3COOH + KOH =
KCH3COO + H2O
ацетат калия
Н+ + ОН - = H2O
Соляная кислота
2
Взаимодействие с оксидом меди (2+)
После нагревания содержимое пробирки окрасилось в голубой цвет
CuO + 2HCl = CuCl2 + H2O
хлорид меди (2+)
СuO + 2H+ = Cu2+ + H2O
Взаимодействие с раствором щелочи
Метиловый оранжевый окрасился в красно - розовый цвет, который при добавлении гидроксида калия исчезает
HCl + KOH = KCl + H2O
Хлорид калия
Н+ + ОН - = H2O
Вывод: Карбоновые кислоты взаимодействуют с оксидами металлов и основаниями
Задание группе № 3. Слайд № 8
Взаимодействие уксусной и соляной кислот
с солями и нерастворимыми основаниями
Опыт 1. Налейте в одну пробирку 2 - 3 мл раствора сульфата меди (2+) и прибавьте 1 - 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем прилейте немного уксусной кислоты. Во вторую пробирку налейте 1 - 2 мл уксусной кислоты, затем добавьте раствор карбоната натрия.
Опыт 2. Налейте в одну пробирку 2 - 3 мл раствора сульфата меди (2+) и прибавьте 1 - 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем прилейте немного соляной кислоты. Во вторую пробирку налейте 1 - 2 мл соляной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующие выводы. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы.
Результаты работы группы № 3. Слайд № 11.
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
гидроксид меди (2+)
сульфат калия
Cu2+ + 2OH - = Cu(OH)2
Cu(OH)2 + 2CH3COOH =
Cu(CH3COOH)2 +2H2O
ацетат меди (2+)
Cu(OH)2 + 2Н+ = Cu2+ + 2H2O
Взаимодействие с раствором карбоната натрия
Выделился газ
2CH3COOH + Na2CO3 =
2NaCH3COO + CO2+ H2O
ацетат натрия
2H+ + CO32- = CO2 + H2O
Соляная кислота
2
Взаимодействие с нерастворимым основанием - гидроксидом меди (2+)
При смешивании растворов сульфата меди (2+) и гидроксида калия выпал синий осадок, который растворяется при добавлении раствора соляной кислоты
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
гидроксид меди (+2) сульфат калия
Cu2+ + 2OH - = Cu(OH)2
Cu(OH)2 + 2HCl = CuCl2 +2H2O
хлорид меди (2+)
Cu(OH)2 + 2Н+ = Cu2+ + 2H2О
Взаимодействие с раствором карбоната натрия
Выделился газ
2HCl + Na2CO3 =2NaCl + CO2+ H2O
хлорид натрия оксид углерода (+4)
2H+ + CO32- = CO2 + H2O
Вывод: Карбоновые кислоты взаимодействуют с солями и нерастворимыми основаниями
После выполнения исследования каждая группа представляет свою работу, в результате обсуждения делают общий вывод: Слайд № 12.
Карбоновые кислоты проявляют общие химические свойства,
соответствующие классу кислот.
Учитель. Далее мы переходим к теме нашего урока, какими еще свойствами обладают карбоновые кислоты, в частности, уксусная кислота. (объяснение нового материала). Основные моменты объяснения записываем в рабочей тетради.
1.Диссоциация карбоновых кислот. Слайд № 13.
Отщепление протона водорода от кислоты говорит о том, что уксусная кислота в растворах диссоциирует на ионы: СН3-COOH ↔ СН3-COO- + H+ и образующийся ион водорода придает раствору кислую среду.
Просматриваем видеоролик, в результате делаем вывод: уксусная кислота является слабым электролитом.
2.Карбоновые кислоты обладают и характерными свойствами. Одним их свойств является реакция этерификации - взаимодействие карбоновой кислоты со спиртами, в результате которой образуется сложный эфир. Реакции этерификации равновесные и обратимые. Обратная реакция называется гиролизом. (Просматриваем видеоролик, уравнение реакции записываем в рабочей тетради) Слайд № 14, 15
СН3 - СООН + С2H5 - ОН → CH3 - COO - C2H5 + H2O
R - COO - R1 + H2O → R - COOH + R1 - OH
После просмотра ролика для закрепления материала - задание: Слайд 15
Составить уравнение обратной химической реакции получения сложных эфиров: этилацетата и пропилацетата.
Проверяем задание: СН3 - СОО - С2Н5 + Н2О → СН3 - СООH + С2Н5 - OH
СН3 - СОО - С3Н7 + Н2О → СН3 - СООH + С3Н7 - OH
3. Карбоновые кислоты вступают в реакции замещения, например, с хлором. Слайд №16.
R - CH2 - COOH + Cl2 → R - CHCl - COOH + HCl
Уксусная кислота свтупает в реакции замещения только при нагревании.
СН3 - СООН + Cl - Cl → CH2Cl - COOH + HCl
В результате реакции образуется хлоруксусная кислота.
4.Непредельные карбоновые кислоты вступают в реакции, характерные для непредельных органических соединений - присоединение по кратной связи.
К ним можно отнести реакции гидрирования - присоединения водорода. Слайд № 17.
С17Н33 - СООН + Н2 → С17Н35 - СООН
Галогенирования - присоединение галогена. Сейчас вы просмотрите видеоролик. Так как с реакциями галогенирования мы знакомы - задание:
Cоставить уравнение аналогичной химической реакции соединения акриловой кислоты с бромом.
СН2 = СН - СООН + Br2 → CH2Br - CHBr - COOH
акриловая кислота 2,3 дибромпропановая кислота
В результате работы делаем вывод - непредельные карбоновые кислоты вступают в реакции присоединения.
5.Горение уксусной кислоты. Слайд № 18. Безводная уксусная кислота - огнеопасное вещество. При поднесении горящей лучины ее пары легко загораются. При горении уксусной кислоты образуется углекислый газ и вода. Просмотр видеоролика - горение уксусной кислоты.
СН3 - СООН + 2О2 → 2 Н2О + 2СО2
6.Среди карбоновых кислот существует кислота, которая имеет специфические химические свойства. Речь идет о муравьиной кислоте. Почему она имеет отличия от уксусной кислоты, например?
Рассмотрим строение муравьиной кислоты. Слайд № 19.
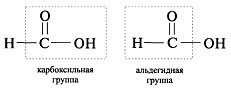
В отличие от уксусной кислоты муравьиная кислота вступает в реакцию «серебряного зеркала».
НСООН + Ag →H2O + CO2 + Ag↓
Муравьиная кислота легко окисляется перманганатом калия, а при нагревании разлагается. Просмотр видеоролика. Слайд № 20.
Н - СООН → СО + Н2О
Мы рассмотрели некоторые свойства карбоновых кислот. Перед нами стоит вопрос - а как получить карбоновые кислоты? Существует несколько способов, но мы рассмотрим два: получение в лаборатории и в промышленности. Слайд № 21.
В лаборатории карбоновые кислоты получают вытеснением кислот из солей более сильной кислотой.
R - COO Na + H2SO4 → R - COOH + NaHSO4
В промышленности карбоновые кислоты получают окислением спиртов, альдегидов, углеводородов.
С2Н5 - ОН + О2 → СН3 - СООН + Н2О
Мы рассмотрели свойства и получение карбоновых кислот. А теперь давайте проверим, как вы поняли материал. Перед каждым из вас небольшой тест - тренировка. Если вы ответили на вопрос верно - переходим к другому слайду; если ответ неверный - перехода не будет.
Тест. Слайды № 22 - 26.
1. Какая функциональная группа определяет принадлежность соединения к классу кислот?
А. - ОН
Б. - СООН
В. - СОН
Г. - С = О
2. При взаимодействии уксусной кислоты с бутиловым спиртом образуется:
А. Этилацетат
Б. Пропилформиат
В. Метилацетат
Г. Бутилацетат
3. Раствор уксусной кислоты реагирует с веществами:
А. HCl
Б. CO
B. Na 2 CO 3
Г. Ag
4. Соли уксусной кислоты называются:
А. формиаты
Б. Цитраты
В.Оксалаты
Г. Ацетаты
5. Определите формулу эфира, образовавшегося в результате следующей реакции:
СН3 - СООН + С3Н7 - ОН → ? + Н2О
А. СН3 - СОО - СН3
Б. СН3 - СОО - С2Н5
В. СН3 - СОО - С3Н7
Г. Н - СОО - СН3
Итак, сегодня на уроке мы рассмотрели химические свойства и получение карбоновых кислот. Проверили свои знания по данной теме. Спасибо за урок.
Литература.
-
Артеменко А.И. Удивительный мир органической химии. М.: Дрофа, 2004;
-
Габриелян О.С. Органическая химия 10 класс. М. Дрофа, 2010
-
Бедроносов С.С. Менделеева Е.А. Новейший справочник. М. Махаон, 2006.
Федеральное бюджетное общеобразовательное учреждение
«Вечерняя (сменная) общеобразовательная школа № 9
УФСИН России по Томской области»
VI Региональный конкурс медиауроков.
Разработка урока на тему:
«Химические свойства и получение карбоновых кислот»
Разработала: учитель химии В(С)ОШ - 9
Авилова Наталья Петровна
Томск 2011.