- Учителю
- Конспект по химии:Сера и ее соединения.
Конспект по химии:Сера и ее соединения.
Тема: Сера и ее соединения.
Класс: 9 «Б»
Дата:
Цель: требующие применения комплексных мыслительных операций.
Образовательные задачи:
-
сформировать у учащихся умения давать характеристику химическому элементу на основании положения его в Периодической системе Д.И. Менделеева и строения атома на примере элемента неметалла - серы;
-
применять полученные знания о физических и химических свойствах серы, нахождении в природе и применении соединений серы, химизме производстве серной кислоты;
-
сформировать навыки решения расчётных задач.
ХОД УРОКА
I. Организационный этап
-
Готовность к уроку;
-
Психо-эмоциональный настрой
II. Сообщение темы и целей урока
- Сегодня мы с вами начинаем изучать новую главу: «Химия
элементов - неметаллов» (слайд 1).
- Давайте вспомним несколько металлов с помощью загадок (слайд 3).
-
Красив в кристаллах и парах, на детей наводит страх.
-
Белый, воздуха боится, покраснел чтоб сохраниться.
-
Хоть многие вещества превращает в яд, в химии она достойна всяческих наград (слайд 2).
-
Гость из космоса пришёл, в воздухе приют себе нашёл.
-
Какой газ утверждает, что он - это не он?
-
Какой неметалл является лесом?
- Сегодня мы с вами познакомимся с неметаллом «Сера», мы узнаем физические свойства серы, получение серы, нахождение в природе а также эффективность использования сырья.
Сера - химический элемент.
- Мы вместе попробуем дать краткую характеристику химическому элементу - сера, по плану (слайд 4).
-
Каков химический знак?
-
В какой группе периодической системы находится?
-
В каком периоде находится?
-
Какой атомный номер?
-
Какая относительная атомная масса?
-
Сколько электронов в атоме? Как располагаются электроны на АО?
- А где встречается сера в природе? На этот вопрос ответят нам ваши коллеги, которые подготовили дополнительную информацию.
(слайд 5): Сера самородная, минерал из класса самородных
элементов. Самородная сера жёлтого цвета, при наличии примесей -
бурая до чёрной; содержит включения битумов, карбонатов, сульфатов,
глины. Блеск смолистый до жирного, хрупкая, плавится при
температуре 119°С; загорается при температуре 214-465°С.
Главные типы месторождений самородной серы - вулканогенные и
экзогенные. Экзогенные месторождения самородной серы преобладают;
они связаны с гипсо-ангидритами, которые под воздействием выделений
углеводородов и сероводорода восстанавливаются и замещаются
серно-кальцитовыми рудами. Геохимические процессы образования
самородной серы существенно активизируются микроорганизмами
(сульфатредуцирующими и тионовыми бактериями).
-
Твёрдое кристаллическое вещество желтого цвета, без запаха.
-
Как и все неметаллы плохо проводит теплоту и не проводит электрический ток.
-
Порошок серы всплывает в воде.
-
Сера в природе практически не растворяется.
-
Температура плавления 120°С (слайд 10).
Серу применяют для производства серной кислоты, вулканизации
каучука, как фунгицид в сельском хозяйстве и как сера коллоидная -
лекарственный препарат</<font face="Times New Roman,
serif">. Также сера в составе серобитумных композиций
применяется для получения сероасфальта, а в качестве заместителя
портландцемента - для получения серобетона (слайд 11).
Химизм производства серной кислоты протекает в 3 стадиях (слайд
12):
(Учащиеся записывают уравнения)
I стадия производства - обжиг:
S + O2 = SO2 + 297 кДж
4FeS2 + 11O2 = 8SO2 +
2Fe2O3 + 3400кДж
При горении серы и обжиге сульфидных руд развивается столь
высокая температура, что оксид серы (VI) оказывается неустойчивым и
поэтому не образуется. В этих реакциях получается
SO2.
Но в серной кислоте H2SO4 сера шестивалентна,
следовательно, для ее получения нужен оксид серы (VI)
SO3. Чтобы ее получить, надо окислить SO2,
т.е. провести реакцию, но при более низкой температуре, чем та,
которая развивается при горение серы или обжиге сульфидной руды.
II стадия производства - окисление сернистого газа:
2SO2 + O2 = 2SO3 + 197 кДж
III стадия производства- растворение оксида серы (Vl) в воде:
SO3 + H2O = H2SO4 + Q
- Рассмотрим пример - задачу (слайд 14, учитель решает у доски, учащиеся записывают решение задачи).
Сырье - пирит содержит 80% полезного вещества FeS2. При обжиге 1 т пирита было получено 800 кг сернистого газа. Определить выход продукта.
Дано:
m(пирита) = 1 т
W (FeS2) = 0,8
mgракт. (SO2) = 800 кг
____________________
W (выхода) - ?
Решение:
1. Определим массу FeS2
M(FeS2) = W(FeS2)*m(пирита)
M(FeS2) = 0,8 * 1000кг = 800кг
2. Вычислим теоретическую массу продукта
800кг x кг
4FeS2 + 11O2 = 8SO2 +
2Fe2O3
М(FeS2) = 120 г/моль
n 4моль 8моль
М(SO2) = 64 г/моль
m 480г 512г
х = ![]() = 853кг
= 853кг
3. Определим выход продукта реакции
W (выхода) = ![]() * 100%
* 100%
W(выхода) = ![]() * 100% = 94%
* 100% = 94%
Ответ: выход продукта составляет 94%
III. Закрепление изученного материала
1. Стихотворение «Сера» (слайд 15):
Сера, сера, сера, эс.
Тридцать два - атомный вес.
Сера в воздухе сгорит,
Мы получим ангидрид.
Ангидрид её с водой
Станет серной кислотой.
Запишите уравнения химических реакций, о которых идёт речь в стихотворении.
2. Напишите уравнения химических реакций, с помощью которых можно осуществить указанные превращения (слайд 16):
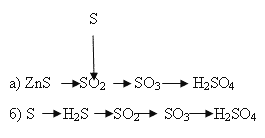
3. Задача: Каков объём (н.у.) слайд 17:
А) сернистого газа получится при обжиге на воздухе 120 г пирита
FeS2
Б) сероводорода получится при обработке 0,88 г сульфида железа (ll)
соляной кислотой.
IV. Рефлексия
Учащимся предлагается продолжить фразу "Уходя с урока, я хочу сказать…". Также проводится оценивание работы учащихся на уроке.
V. Домашнее задание (слайд 18)