- Учителю
- Разработка урока Электрический ток в электролитах
Разработка урока Электрический ток в электролитах
</
-1-
Тема «Электрический ток в электролитах»
Цели: Изучить природу электролиза, ознакомить учащихся с его законами, практическим применением. Способствовать:- развитию умения решать ситуативные задачи с использованием теоретических положений,
-овладению рациональными методологическими подходами в познавательной и практической деятельности.
Оборудование: 1)электролитическая ванна с водным раствором сульфата меди, 2)медные электроды, 3)источник тока, 4)амперметр, 5)весы с гирями, 6)соединительные провода, 7)пуговица, 8) металлические ложки.
Тип: урок комплексного применения знаний.
Формы и методы: 1)самостоятельная работа по решению качественных и расчетных задач, 2)эксперимент, 3)беседа-лекция, 4)работа в группах, 5)сообщения учащихся (работа со справочной литературой)
План
1.Оперативный контроль полученных ранее знаний(2-3 мин)
2.Взаимоконтроль понятий из домашнего конспекта(3-4 мин)
3.Изучение нового материала (лекция-беседа с написанием опорного конспекта) (15 мин)
4. Сообщения учащихся о применении электролиза (5 мин)
5. Осмысление изученного на уроке (15 мин)
Работа в группах
I группа II группа III-Vгруппа
Проведение
эксперимента Решение качественных задач
Решение расчётных задач
-2-
6.Итог урока (3мин)
7. Задание на дом (2 мин)
Ход урока:
I. Проверка ранее изученного материала (индивидуальные карточки)
I вариант II вариант
-
Носителями свободных зарядов являются
- в металлах
- в газах
1) Носителями свободных зарядов
являются
- в вакууме
- в полупроводниках
-
Укажите графики зависимости сопротивления от температуры
в полупроводнике в металле
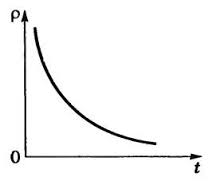 1
1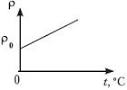
3) В обычных условиях газы 3)Искровой разряд является..
являются…
4) Примеси, приводящие к увеличению 4) Примеси, захватывающие электроны
концентрации электронов в полупро- от соседних атомов в
воднике являются… проводнике …
II. Мотивация урока.
На столе пуговица металлическая, алюминиевая и никелевая ложки. Общее между этими предметами - процесс, который используется для их изготовления - электролиз.
Этот процесс нашел свое применение в современном промышленном производстве.
III. Проверка взаимоконтролем в парах из домашнего конспекта определений
1)электролитическая диссоциация,
2) окислительно - восстановительная реакция,
3)рекомбинация,
4)электролиз.
-3-
Проговаривание этих определений вслух.
IV. Изучение нового материала (беседа, лекция)
Понятие электролитов, ионы-анионы, катионы.
Создание электрического поля в них между токопроводящими
пластинами-электродами. Знакомство с законами электролиза.
1 группа - выполняет эксперимент.
Опорный конспект на доске.
Электролиз - процесс выделения веществ на электродах в результате окислительно-восстановительной реакции в электролитах.
Электролиты - соль, кислота, щелочь в воде.
m=kIt (1)

физический смысл k-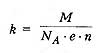 электрохимический эквивалент вещества, численно равный заряду в 1
Кл,
электрохимический эквивалент вещества, численно равный заряду в 1
Кл,
-4-
прошедшему через электролит.
m=M∙I∙t/e∙Na∙ n (2)
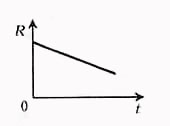
График зависимости сопротивления от температуры в электролитах
Применение электролиза (из сообщений выступающих) 1)рафинирование - очистка от примесей,
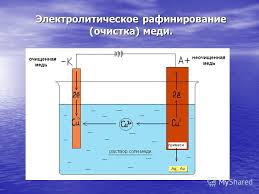
-
гальваностегия-покрытие тонким слоем,

-5-
3)гальванопластика - получение копий, матриц,

4)электрометаллургия - получение веществ с помощью электролиза руд.
V. Осмысление изученного.
Один из учащихся выводит формулы
Из (1): k=
I=
t=
Из (2): e=
-6-
Организация самостоятельной работы в группах (опора параграф 75 учебника; таблица электрохимических эквивалентов веществ).
I группа: Проведение эксперимента с водным раствором
Диссоциация:
На анод: m
На катод: m
В растворе остается:
Расчет массы выделившейся меди на электроде.
I способ - применив I закон электролиза m=kIt
II способ - путём взвешивания электрода до и после электролиза
II группа: Метод мозгового штурма по решению качественных задач
1. Почему при прохождении через электролиты электрического тока они нагреваются?
2. Почему провода осветительной сети непременно имеют резиновую оболочку, а провода в сырых помещениях бывают просмолены снаружи?
3. Почему гораздо опаснее браться за электрические провода мокрыми руками, чем сухими?
III, IV, V группы - решение расчётных задач
III группа - задачи среднего уровня
Например:
1) При электролизе выделенные из раствора ионы металлов переходят, теряя заряд на катоде. Каким образом пополняется количество ионов металлов в растворе?
2) найти электрохимический эквивалент 2-хвалентного кобальта?
IV группа - задачи достаточного уровня
-
Определите массу серебра, выделившегося на катоде при электролизе азотнокислого серебра за 2 ч, если к раствору приложено напряжение 2В
-7-
(m= )
2) Каковы затраты энергии на получение 1 кг алюминия, если электролиз соли алюминия ведется под напряжением 5,5 В? (k = )
V группа - задачи высокого уровня
1) Никелирование металлической пластинки с площадью поверхности 48 см2 продолжалось 4 ч при силе тока 0,15 А. Определите толщину слоя никеля. Валентность никеля - 2.
2) При электролизе подкисленной воды через ванну прошел заряд 2500 Кл. Выделившийся кислород находится в объёме 0,5 л под давлением 101 кПа. Какова абсолютная температура Т?
VI. Подведение итогов.
Краткий обзор опорного конспекта. Оценивание результатов эксперимента. Оценивание результатов ответов на качественные вопросы. Сверка бригадирами ответов решенных задач с решением учителя (на доске с обратной стороны алгоритм решения всех задач III, IV и V групп).
VII. Домашнее задание.
Параграф 75 - выучить опорный конспект. Задачи №1; 2; 4 (стр. 273), подг. к Л.р. по определению заряда электрона.