- Учителю
- Первый закон термодинамики и его применение к изопроцессам. Адиабатный процесс.
Первый закон термодинамики и его применение к изопроцессам. Адиабатный процесс.
Урок физики в 10 (базовый уровень изучения физики)
Учитель: Зинковская В.Н..
Тема урока: 1 закон термодинамики и его применение к изопроцессам. Адиабатный процесс.
Цель урока: проанализировать как изменяется внутренняя энергия и работа в различных процессах, рассмотреть случаи применения первого закона термодинамики.
Тип урока: комбинированный
</ Средства обучения: мультимедийный проектор, дидактический материал, компьютерная презентация.
Методы обучения: репродуктивные (рассказ, эвристическая беседа), частично-поисковые (работа с дидактическим материалом, учебником), самостоятельная работа в парах, элементы проблемного обучения.
Ход урока
-
Организационный момент.
-
Актуализация знаний.
Беседа с учащимися:
1. Что означают слова «Перпетум мобиле?». Перпетуум-мобиле (латинское perpetuum mobile переводится как «вечное движение» или «вечно движущееся») - вечный двигатель.
Так, Леонардо да Винчи (1452-1519г.г.) писал: «О, искатели постоянного двигателя, сколько пустых проектов создали вы в подобных поисках» И в 1775 году Французская академия наук заявила: « Построение вечного двигателя абсолютно невозможно», и проекты вечных двигателей рассматривать перестала? Почему?
Мы попытаемся сегодня на уроке на этот вопрос ответить.
Для этого вспомним пройденный материал.
Что такое энергия? А что вы знаете об энергии?
Энергия в природе не возникает из ничего и не исчезает:
количество энергии неизменно, она только переходит из одной формы в
другую
III. Изучение новой темы.
Закон сохранения энергии был установлен в середине Х1Х века на основе работ, выполненных несколькими знаменитыми учёными. Немецкий учёный Р. Майер высказал теоретические положения, англичанин Д. Джоуль провёл экспериментальные исследования, а немецкий физик Г. Гельмгольц вывел результаты на все явления.
Закон сохранения энергии, распространенный на тепловые явления получило название 1 закона термодинамики или 1 начало термодинамики.
Данный закон объединяет оба способа изменения внутренней энергии. Повторение мат-ла: определение внутренней энергии, способы изменения внутренней энергии, виды теплопередач.
Математическое выражение: ΔU=Q+А ,
Изменение внутренней энергии системы, при
переходе ее из одного состояния в другое, равно сумме работы
внешних сил и количества теплоты, переданной системе: ![]() U = A + Q
U = A + Q
Если система изолирована и под ней не
совершается работа, и не обменивается теплотой с окружающей средой
Q = 0 , то ![]() U = U2 - U1 = 0 т.е. U1 =
U2, U = пост.
U = U2 - U1 = 0 т.е. U1 =
U2, U = пост.
Внутренняя энергия изолированной системы неизменна. Часто вместо
работы внешней силы над системой А рассматривают работу газа
(системы) А' , A' = -A, получаем Q = ![]() U + A'
U + A'
Количество теплоты, переданное системе, идет на изменение
внутренней энергии и на совершение системой работы над внешними
телами.
Докажем с помощью 1 закона термодинамики невозможность создания
вечного двигателя.
Вечный двигатель - воображаемое устройство, способное
бесконечно совершать работу без затрат топлива или других
энергетических ресурсов.
Если Q=0, то ΔU= - А или -ΔU= А., то есть двигатель перестаёт
работать, если запас внутренней энергии будет исчерпан. Первый
закон термодинамики объясняет теоретическую невозможность создания
вечного двигателя. Но ещё до открытия этого закона многовековая
практика привела учёных к выводу: нельзя совершать работу без
затраты внешней энергии.
С помощью первого закона термодинамики можно делать заключения о характере протекания различных процессов. Мы знаем три изопроцесса. Назовите их.
Для того чтобы сказать как применяется закон к конкретному изопроцессу, надо проанализировать как изменяется внутренняя энергия при этом процессе, какая работа при этом совершается.
Сейчас каждая группа попробует применить первый закон термодинамики к одному из процессов.
Заполните соответствующую строчку таблицы. (Приложение 1)
Давайте посмотрим, как справились с заданием. Работа в группах по 4-5человек и раздается бумажный вариант каждой группе. На доске чертится подобная таблица, которая потом заполняется одним из учеников группы и озвучивается результат самостоятельной работы. Перед началом самостоятельной работы повторяются изопроцессы, как записывается математически каждый закон, его название. Здесь представлен тот результат, к которому должны прийти ученики.
ПРИМЕНЕНИЕ 1 ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ.
Постоянные
График
Изменение
внутренней
энергии
Запись
1-го закона
термодинамики
Физический
смысл
Изотермическое
расширение
m=const
M=const
T=const
pV=const
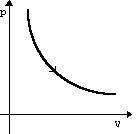
U=const
ΔU=0
Q=A'
Изотермический
процесс не может происходить без теплопередачи. Все количество теплоты, переданное системе, расходуется на
совершение этой
системой
механической работы.
Изотермическое
сжатие
m=const
M=const
T=const
pV=const
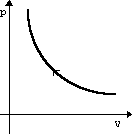
U=const
ΔU=0
A=-Q
Изотермический
процесс не может происходить без теплопередачи.
Вся работа внешних
сил выделяется в виде
тепла.
Изохорное
нагревание
m=const
M=const
V=const![]()
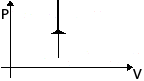
p↑
T↑
U↑
ΔU>0
A=0
Q= ΔU
Все количество
теплоты, переданное системе, расходуется
на увеличение ее
внутренней энергии.
Изохорное
охлаждение
m=const
M=const
V=const![]()
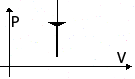
p↓
T↓
U↓
ΔU<0
A=0
Q= ΔU<0
Система уменьшает
свою внутреннюю
энергию, отдавая тепло окружающим
телам.
Изобарное
расширение (нагревание)
m=const
M=const
p=const
![]()
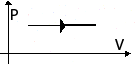
V↑
T↑
U↑
ΔU>0
Q=ΔU+A'
ΔU=Q-А'>0
Количество теплоты, переданное системе, превышает
совершенную ею механическую работу.
Часть тепла
расходуется на
совершение работы,
а часть - на
увеличение
внутренней
энергии.
Изобарное
сжатие (охлаждение)
m=const
M=const
p=const
![]()
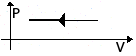
V↓
T↓
U↓
ΔU<0
ΔU=Q+A<0
Q<0
Количество теплоты, отдаваемое системой, превышает работу
внешних сил. Часть тепла система
отдает за счет
уменьшения
внутренней энергии.
Рассмотрим процесс, который идет без теплообмена с окружающей средой. Такой процесс называется адиабатным.
Количество теплоты, полученное системой равно 0. Q=0 график адиабаты так же как и изотерма - кривая линия, но гораздо круче.
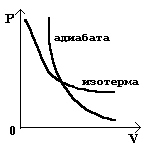
ΔU= - A1
При адиабатном сжатии получаем ΔU >0
В реальных процессах полной теплоизоляции достичь очень трудно, но в ряде случаев можно считать процессы близкими к адиабатным. Если процесс происходит очень быстро, то система не успевает обменяться теплом с окружающей средой. Внутренняя энергия возрастает, газ нагревается. Такой процесс происходят в дизельном двигателе
При адиабатном расширении получается обратный эффект. Газ сам совершает работу. Т.к. дополнительного поступления теплоты нет, то внутренняя энергия тратится на совершение работы газом, т.е. уменьшается. Газ охлаждается.
Адиабатный процесс встречается и в природе. Именно с адиабатным процессом связано образование облаков.
Рассмотрим процесс образования облака.
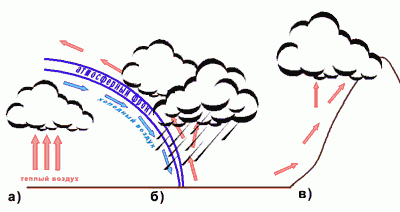 Масса достаточно влажного воздуха поднимается вверх. Почему воздух
поднимается вверх?
Масса достаточно влажного воздуха поднимается вверх. Почему воздух
поднимается вверх?
-
Поднимающийся вверх воздух будет охлаждаться (адиабатное расширение, т.к. воздух поднимается относительно быстро)
-
Воздух охладится настолько, что начинается конденсация водяных паров.
-
Поступающий снизу воздух способствует вертикальному развитию облака
-
Конвекция, поток воздуха может встретить горы или другие возвышения, взаимодействие теплых и холодных фронтов
-
Физика образования облаков сложная, какое это будет облако зависит и от температуры, и от влажности воздуха, от рельефа местности и т.д.
Мы с вами обладаем уникальной возможностью увидеть самые высокие облака - серебристые. Эти облака наблюдаются только летом и только на средних широтах на высоте 80 км над землей. Эти облака светятся под лучами солнца, опустившегося за горизонт или ещё не поднявшегося из-за горизонта.
IV Закрепление
Давайте проверим, чему вы научились на уроке, решая практические задачи.
Задачи для фронтального решения:
1. При изотермическом расширении идеальным газом совершена работа 15 кДж. Какое количество теплоты сообщено газу? (Q=15 кДж)
2. В закрытом баллоне находится газ. При охлаждении его внутренняя энергия уменьшилась на 500 Дж. Какое количество теплоты отдал газ? Совершил ли он работу? (Q=500 Дж, А=0)
3. Быстрый подъем воздушных масс определенной влажности приводит к образованию облака. Как при этом изменяется внутренняя энергия? (При адиабатном расширении газа его внутренняя энергия уменьшается, газ охлаждается)
V. Подведение итогов. Установление достижения цели урока.
VI. Домашнее задание. Решить задачи: Ученики сами выбирают какой уровень решать в зависимости от уровня подготовки.
Разноуровневые задачи на применение 1 закона термодинамики к
изопроцессам.
1 уровень
1.При изотермическом расширении газ совершил работу 50 Дж. Найдите
изменение его внутренней энергии и количество теплоты, переданное
ему в этом процессе.
2.Идеальный газ нагрели в закрытом сосуде, передавая ему 150 Дж
теплоты. Какую работу совершил газ? Как в этом процессе изменилась
его внутренняя энергия?
3.В изотермическом процессе газу было передано 150 Дж теплоты.
Какую работу совершил газ в этом процессе? Как изменилось его
давление, если объём увеличился в 2 раза?
4.Температура 2 моль идеального газа, находящегося в закрытом
сосуде, увеличилась с 20 ˚ С до 100˚ С. Какое количество теплоты
было передано газу в этом процессе?
5.При изохорном охлаждении внутренняя энергия уменьшилась на 350
Дж. Какую работу совершил при этом газ? Какое количество теплоты
было передано газом окружающим телам?
6.При адиабатном расширении 5 моль водорода была совершена работа в
68 кДж. Найдите изменение внутренней энергии газа и количество
теплоты, которым обменивались тела в этом процессе.
7.При адиабатном сжатии газа над ним была совершена работа в 200
Дж. На сколько и как изменилась при этом внутренняя энергия газа?
2 уровень
1.При охлаждении идеальный газ, находящийся в герметическом сосуде,
передал окружающим телам 200 Дж теплоты. Найдите температуру газа в
конце процесса, если сначала его температура была равна 200˚ С.
Количество вещества в сосуде 5 моль.
2.Какое количество теплоты потребуется, чтобы изобарно увеличить
температуру 2 моль идеального газа с 20˚С до 120˚С?
3.Какое количество теплоты будет отдано холодильнику при изобарном
сжатии 5 моль
идеального газа от 5 л до 3л при нормальном атмосферном давлении?
Каким будет в этом процессе изменение внутренней энергии газа?
4.Для изобарного нагревания 800 моль газа на 500 К газу сообщили
количество теплоты 9,4 МДж. Определите работу газа и приращение его
внутренней энергии.
5.В вертикальном цилиндре под тяжёлым поршнем находится кислород
массой 2 кг. Для повышения температуры на 5 К ему сообщили
количество теплоты 9160 Дж. Найдите работу, совершённую газом при
расширении, и увеличение его внутренней энергии.
Молярная масса кислорода 32 · 10![]() кг/моль
кг/моль