- Учителю
- Урок решения задач по теме Газовые законы
Урок решения задач по теме Газовые законы
Конспект урока по теме «Решение задач по теме
«Уравнение Менделеева- Клапейрона.
Газовые законы» (10 класс).
Цель: активизация познавательной деятельности учащихся при изучении темы за счет включения в исследовательскую работу с использованием ИКТ.
Задачи:
Образовательные:
-повторить зависимость между двумя изменяющимися термодинамическими параметрами при неизменном третьем,
-показать применение газовых законов с помощью эксперимента.
Воспитательные:
-продолжить воспитание личностных качеств: самостоятельности, ответственности, толерантности;
-формирование взаимопомощи, доброжелательного отношения друг к другу, развивать культуру общения и культуру ответа на вопросы;
-умение выслушать других при работе в классе, в группах;
- формировать навыки безопасной работы.
Развивающие:
-развивать приемы исследовательской работы, умения анализировать, делать выводы.
-вырабатывать умения объяснять газовые законы на основе положений МКТ;
-описывать состояние и изопроцессы идеального газа,
-давать и объяснять графическое изображение процессов.
Метод:
-групповая исследовательская деятельность с применением ИКТ, наглядный, словесный, самостоятельная работа, мультимедиа.
Средства:
-интерактивная доска,
-лабораторное оборудование,
-дидактические материалы,
-презентация.
Место урока в разделе « Молекулярная физика. Тепловые явления»
- урок проводится в 10 классе в главе «Уравнение состояния идеального газа» после изучения основ МКТ, понятия температуры и введения уравнения Менделеева-Клапейрона и газовых законов.
Ход урока.
-
Организационный этап. Цель этапа: создание позитивного эмоционального настроя учеников на урок.
Сегодня вы попробуете повторить путь известных физиков и самостоятельно использовать на практике формулировки газовых законов.
По сравнению с 17-18 в. для вас эта задача значительно упрощена. Выступая в роли исследователей, вам самим придётся анализировать увиденное, делать выводы, объяснять результаты. А чтобы незначительно облегчить вам исследования, проговорим немного основные понятия, которые потребуются для объяснения увиденного.
Эпиграф к нашему уроку: «Лучше всего продвигается естественное исследование, когда физическое завершается в математическом» Ф.Бэкон.
-
Актуализация по теме.
Цель этапа: повторить основные теоретические знания.
Задание 1. Заменить цепочку понятий на цепочку формул.
М
 олярная масса уравнение
Менделеева-Клапейрона уравнение Клапейрона для постоянной массы
олярная масса уравнение
Менделеева-Клапейрона уравнение Клапейрона для постоянной массы
 Закон
Бойля-Мариотта
Закон
Бойля-Мариотта
 Закон
Шарля закон Гей-Люссака
Закон
Шарля закон Гей-Люссака
Задание 2. Найти графическое изображение процесса. Цифру ответа внести в таблицу.
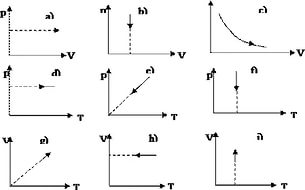
-
Основной этап.
Цель этапа: сформировать новые навыки и умения при решении различного рода задач.
Работа в группах по 4-5 человек. Группы получают задания на карточках- инструкциях. Учащиеся объединены в группы по уровню подготовки.
Задание 1. Экспериментальные задачи. Выполнить эксперимент и объяснить результат с точки зрения молекулярного строения вещества.
Группа 1. Опыт "Яйцо в бутылке":
Оборудование: бутылка с широким горлышком, яйцо, ватка, смоченная в спирте, спички.
Опыт: В бутылку опустите горящую ватку, предварительно смоченную в спирте. Сверху положите очищенное, сваренное вкрутую яйцо. Почему яйцо проваливается в бутылку?
Объяснение: при нагревании воздух в бутылке расширяется. Когда мы закрываем горлышко бутылки яйцом и горение прекращается, воздух начинает остывать. Его давление становится меньше атмосферного, и яйцо втягивается внутрь.
Группа 2. Опыт «Без булькания».
Оборудование: Медицинская грелка, пластмассовая бутылка 1,5л, заполненные водой.
Опыт. Перелейте воду из грелки и бутылки в емкость. Почему при выливании воды из медицинской грелки не слышно такого «булькания», как при выливании воды из стеклянной бутылки?
Объяснение: По мере вытекания воды из стеклянной бутылки объём, находящегося над водой воздуха возрастает, согласно закону Бойля-Мариотта, давление уменьшается. Когда разность давлений снаружи и внутри становится достаточно большой, некоторая «порция» воздуха, т.е. воздушный пузырёк, прорывается внутрь бутылки, создавая характерное «булькание». Давление внутри бутылки при этом несколько возрастает. Через некоторое время процесс повторяется. Если же стенки сосуда, из которого вытекает вода, не являются жёсткими, то по мере вытекания воды атмосферное давление сплющивает этот сосуд. Давление внутри сосуда остаётся практически равным атмосферному и «булькание» не возникает.
Группа 3. Опыт "Картезианский водолаз".
Оборудование: пластмассовая бутылка 1,5 л, заполненная водой с крышкой; медицинская пипетка, заполненная подкрашенной водой.
Опыт: Бутылка, наполненная водой, внутри которой плавает пипетка. Закроем плотно колбу крышкой и возьмем колбу в руки - пипетка погружается, уберем руки, пипетка всплывает. Объясните действие пипетки.
Объяснение: когда берем мягкую бутылку в руки, то ее сдавливаем. Это приводит к увеличению давления внутри бутылки и уменьшению объема пузырька воздуха в пипетке, т.е. по закону Бойля-Мариотта увеличение давления на газ (воздух в пипетке) приводит к уменьшению объема этого воздуха (сжатию). При этом уменьшается сила Архимеда и пипетка тонет. Меняя нажим на бутылку, можно изменять эту силу и управлять глубиной погружения пипетки. Для этого принципиально важно, чтобы бутылка была герметично закрыта.
Группа 4. Опыт "Как поставить медицинские банки".
Оборудование: стакан с тонкими стенками, тарелка, вода, спички, бумага.
Опыт: в стакан вносим горящую бумагу и держим там 1-2 мин, затем стакан переворачиваем и опускаем в тарелку с водой. Вода втягивается в стакан.
Объяснение: при нагревании воздух в стакане расширился, и его часть вышла из стакана. При охлаждении воздух в стакане сжимается, и вода заполняет пустое место под действием атмосферного давления, которое на протяжении всего опыта не менялось.
Группа 5. Опыт "Разрушение банки".
Оборудование: пластмассовая или металлическая банка с закручивающейся крышкой, очень горячая вода, сосуд с холодной водой.
Опыт: налить горячую воду в банку подержать там 2 мин. и вылить, быстро закрыв отверстие. Затем сразу облить ее холодной водой. Банку сплющит.
Объяснение: Во время нагревания вода расширяется, превращаясь в газ - пар. Когда мы закрыли банку крышкой, воздух внутри остался под таким же давлением, как окружающая атмосфера. Охлаждая ёмкость извне, мы заставили пар превращаться обратно в воду. Его давление понизилось, позволяя большему давлению воздуха внешней атмосферы раздавить банку.
Задание 2. Группы получают задания на карточках. Представитель группы показывает решение на доске. Остальные участники групп вносят решения в опорные листы каждого.
Группа 1.
1. Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
2. Температуру воздуха в комнате подняли с t1 = 7 °С до t2 = 27 °С. Какая масса воздуха должна выйти из комнаты, чтобы давление осталось неизменным, Р = 105 Па? Объем воздуха в комнате V = 50 м3.
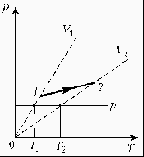
3. На диаграмме РT изображен цикл идеального газа постоянной массы. Изобразите его на диаграмме Р,V.
-
Группа 2.
1. Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температураТ = 300 К. Определить массу газа.
2. Стеклянная колба закрыта пробкой и взвешена при температуре t1 = 15 °С. Открыв пробку, колбу нагрели до температуры t2 = 80 °С. При следующем взвешивании масса колбы оказалась на m = 0,25 г меньше. Чему равен объем колбы?
3. Для постоянной массы идеального газа представлен цикл на диаграмме РV. Изобразить этот цикл на диаграмме VT.
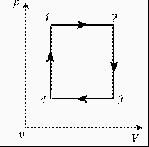 Группа 3.
Группа 3.
1. При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
2. В баллоне емкостью V = 12 л находится азот массой m1 = 1,5 кг при температуре t1 = 37°С. Каким станет давление в баллоне при температуре t2 =50 °С, если выпустить 35% азота? Первоначальное давление считать нормальным.
3. Изобразите на диаграмме РТ цикл постоянной массы идеального газа, представленный на диаграмме РV.
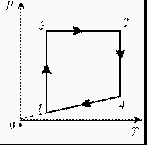
Группа 4.1. Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
2. В сосуде объемом V = 1 л находится идеальный газ.В сосуде объемом V = 1 л находится идеальный газ. Сколько молекул газа нужно выпустить из сосуда, чтобы при понижении температуры в k=2 раза его давление уменьшилось в z =4 раза?
3. Какая из двух линий графика соответствует большему давлению данной массы идеального газа?
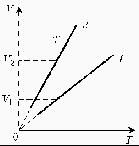
Группа 5.
1. До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении ,но при температуре Т2 = 200 К?
2. Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%, а абсолютная температура на 20%. Какую часть газа выпустили?T2 = 0,8T1
Р2 =0,6Р1
m2=0,65m1
Для каждого состояния газа запишем уравнение Менделеева-Клапейрона.
,Р-1.V=,,m-1.R,T-1.-μ.,m-1.=,,Р-1.Vμ-R,T-1..,m-2.=,,Р-2.Vμ-R,T-2..,∆𝑚-,𝑚-1..=,,m-1.−,m-2.-,m-1..=1−,,m-2.-,m-1..=1−,,Р-2.VμR,T-1.-R,T-2.,Р-1.Vμ.=1−,,Р-2.,T-1.-,T-2.,Р-1..
,∆𝑚-,𝑚-1..?
,∆𝑚-,𝑚-1..=1−,,0,6Р-1.∙,T-1.-,0,8T-1.,∙Р-1..=1−,0,6-0,8.=0,25
3. 3. При нагревании идеального газа постоянной массы получена зависимость Р(T) при переходе из состояния 1 в состояние 2. Как при этом переходе менялась плотность газа?
-
Закрепление учебного материала.
Цель этапа: первичная проверка знаний обучающихся по теме.
Тестирование с последующей самопроверкой и самооцениванием. Тест предлагается из сборника В.А. Орлова «Тематические тесты по физике. 10 класс». Критерии оценивания даются перед началом работы на слайде презентации.
5.Рефлексия. Подведение итогов урока.
Цель этапа: оценить эмоциональное состояние обучающихся по итогам урока.
Учащиеся обводят на листе тетради свою ладонь, на каждом пальце нарисованной ладони пишут: я узнал…, я научился…, я не понял…,мне трудно…, я хочу узнать…и вписывают ответы на итогам урока.
Д
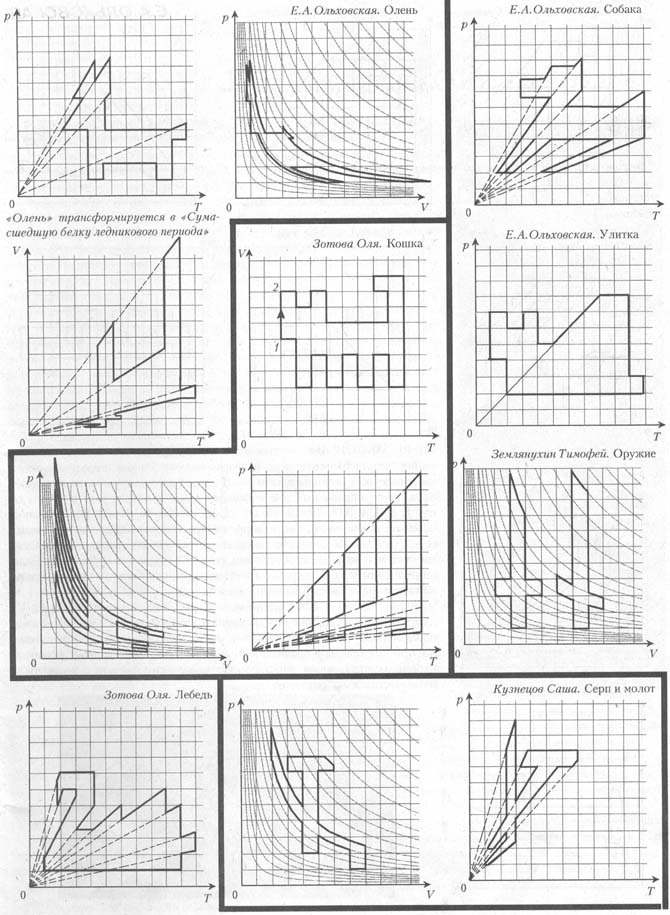 омашнее задание: с
помощью графиков газовых законов нарисовать животных. Например,
кошку, собаку, оленя и т.д.
омашнее задание: с
помощью графиков газовых законов нарисовать животных. Например,
кошку, собаку, оленя и т.д.
Опорный лист учащегося (ейся) 10 _____ класса
ФИ ________________________________________
-