- Учителю
- Урок физики Температура. Решение задач на газовые законы и уравнение Менделеева-Клапейрона. Закон Дальтона»
Урок физики Температура. Решение задач на газовые законы и уравнение Менделеева-Клапейрона. Закон Дальтона»
Тема: «Температура. Решение задач на газовые законы и уравнение
Менделеева-Клапейрона. Закон Дальтона»
Цели:
1. Образовательная цель:
ввести понятие абсолютного нуля температуры, абсолютной шкалы температур; раскрыть физический смысл постоянной Больцмана; связь температуры со средней кинетической энергией поступательного движения молекул; проконтролировать степень усвоения следующих основных умений и навыков, изученных и сформированных на предыдущих уроках: газовые законы, уравнение Менделеева-Клапейрона, закон Дальтона;
2. Развивающая цель:
развитие речи и умение выделять главное, развитие способностей ориентироваться в основных понятиях физики;
3. Воспитывающая цель:
дать возможность почувствовать свой потенциал каждому учащемуся, продолжить формирование умений излагать мысли вслух, устанавливать причинно-следственные связи, работать с учебником.
Тип урока: урок систематизации и обобщения изученного материала.
Методы обучения: вербальный, проблемно-поисковый.
Форма организации: индивидуальная, фронтальная, групповая.
Оборудование и материалы:
Этапы урока:
I. Организационный этап.
II. Этап подготовки учащихся к активному усвоению знаний.
III. Этап обобщения и систематизации изученного.
IV. Этап информации учащихся о домашнем задании и инструктаж по его выполнению.
Ход урока:
I. Организационный этап.
Проверка подготовленности учащихся к уроку, постановка целей и задач урока.
Здравствуйте, уважаемые ребята! Сегодня на этом учебном занятии мы введем понятие абсолютного нуля температуры, абсолютной шкалы температур; раскроем физический смысл постоянной Больцмана; связь температуры со средней кинетической энергией поступательного движения молекул;
проверим степень усвоения вами следующих основных умений и навыков, изученных и сформированных на предыдущих уроках: газовые законы, уравнение Менделеева-Клапейрона, закон Дальтона.
II. Этап подготовки учащихся к активному усвоению знаний.
Иллюзии и слова гибнут -
факты остаются.
Д.И. Писарев.
Температуру измеряют сотни лет, но на вопрос, что это такое, до сих пор ответит далеко не каждый. Человек издавна проявлял интерес к температуре, хоти бы потому, что она определяет его собственное самочувствие (больной человек «горячее»). Кстати, само слово temperatura (лат.) переводится как «смесь» и произошло от смешивания лекарств, которым приписывали тепловое действие на организм.
В XVI веке стали появляться термометры (прообраз термометра изобрел еще Галилей), но что именно они измеряют, оставалось непонятным. Дело в том, что термометры измеряют не саму температуру, а тот или иной термометрический параметр, например, объем столбика ртути, то есть они измеряют температуру косвенно. Для градуирования термометров выбирают две опорные точки. Р. Гук вместе с X. Гюйгенсом установили в качестве постоянных точек термометра - температуры таяния льда и кипения воды. В этих точках термометрический параметр, например, длина столбика ртути (при постоянном его сечении), имеет разные значения, интервал между которыми делят на равные части. Каждая часть определяет единицу измерения - градус температуры. Затем задают начало отсчета шкалы.
В соответствии с этим возникли разные шкалы температур (Реомюра, Фаренгейта, Цельсия). В нашей стране с XVIII века узаконена шкала Цельсия, по которой градус Цельсия (°С) определяется тем, что за 0 °С принята температура таяния льда, а за 100 °С - температура кипения воды (А. Цельсий - шведский физик и астроном, работавший в первой половине XVIII века).
Надо сказать, что непонимание физического смысла температуры не мешало широко ею пользоваться - в этом смысл использованного здесь эпиграфа. Если известно, что при t=39 °С человек болен, а при t= -39 °С ртуть замерзает, то термометр оказывается очень полезным инструментом независимо от того, что именно означают его деления. Таким образом, было установлено много важных закономерностей.
Итак, мы знаем, что в состоянии теплового равновесия все газы имеют одинаковую температуру, не зависящую от рода газа. Для определения температуры выясним, какая еще физическая величина обладает таким же свойством.
Из курса физика-VII известно, что с увеличением скорости молекул температура тела возрастает. При нагревании газа в замкнутом сосуде давление газа возрастает. Согласно же основному уравнению МКТ: давление р прямо пропорционально средней кинетической энергии поступательного движении молекул, т.е.
р = п.
При тепловом равновесии, если давление газа данной массы и его объем фиксированы, кин молекул газа должна иметь строго определенное значение, как и температура.
Можно предположить, что при тепловом равновесии именно средние кинетические энергии молекул всех газов одинаковы. Практически такую проверку произвести невозможно, так как измерить кин молекул очень трудно. Но с помощью основного уравнения МКТ ее можно выразить через макроскопические параметры.
Известно, что
р = пкин (А)
n = (Б)
N = (В)
Подставим (Б) в (А):
р = кин = кин (Ι)
Давление и объем измеряются непосредственно. Число молекул можно определить, зная массу газа m, постоянную Авогадро и молярную массу М.
Если кинетическая энергия Екин действительно одна и та же величина для всех газов в состоянии теплового равновесия, то и величина должна быть тоже одинаковой для всех газов. Только опыт может подтвердить или опровергнуть данное предположение.
Опыт 1. (Возьмем три сосуда с разными газами,
например, с водородом, гелием и кислородом и поместим их в тающий
лед). Подождем, пока не установится тепловое равновесие, и давление
газов перестанет меняться (см. рис.). 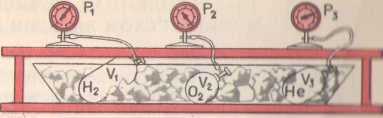
После этого можно утверждать, что все газы имеют одинаковую температуру 0°С. Давления газов р, их объемы V и число молекул N различны. Найдем отношение для водорода (возьмем 1 моль водорода, занимающий объем 0,1 м3).
= = 3,76·10-21 Дж
Для - = 3,76·10-21 Дж
Вывод 1. В тепловом равновесии величина равная произведению давления газа на его объем, деленная на число молекул для всех газов одинакова (выполняется это условие для достаточно разреженных газов, когда их можно считать идеальными):
= = = Θ0°(тэта) - для всех газов при данной t°С.
Опыт 2. (Если же сосуды с газами поместить в кипящую воду при нормальном атмосферном давлении)
= Θ100° = 5,14·10-21 Дж,
т.е. по-прежнему будет одним и тем же для всех газов, но больше, чем предыдущее.
Вывод 2. Величина равная произведению давления газа на его объем, деленная на число молекул пропорциональна температуре.
= k·T (ΙΙ) от температуры Θ выражаемой в энергетических единицах, перейдем к температуре T выражаемой в привычных градусах. T называется абсолютной.
Вычислим коэффициент пропорциональности в формуле (ΙΙ). Мы знаем значения Θ при 0°С и 100°С; обозначим абсолютную температуру при 0°С через Т1, а при 100°С через Т2.
Тогда, согласно уравнению Θ = k·T , получим
Θ100° = k·T2
Θ100° - Θ0° = k(T2 - T1) k = =
Θ0° = k·T1
= () = 1,38·10-21
Коэффициент пропорциональности в формуле (ΙΙ) называется постоянной Больцмана (в честь австрийского физика - одного из основоположников МКТ)
k = 1,38·10-21
k показывает насколько изменяется кинетическая энергия молекул при изменении температуры на 1°С.
Постоянная Больцмана связывает энергетическую температуру с температурой измеряемой в кельвинах.
Проанализируем формулу (ΙΙ):
= k·T Т, определяемая формулой, не может быть «-», так как все величины стоящие в левой части заведомо «+».
Следовательно, наименьшим возможным значением Т может быть Т = 0, если р или V равны 0.
Итак, предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулем температуры.
Это самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказывал Ломоносов.
В середине 19 в. английский ученый У. Кельвин (1824-1907) ввел абсолютную шкалу температур. Нулевая температура по абсолютной шкале (ее называют также шкалой Кельвина) соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия.
Единица абсолютной температуры в СИ называется кельвином (обозначается буквой К).
(Рассказ учащегося о У. Кельвине. Презентация.)
Зная постоянную Больцмана, вычислим скольким градусам Кельвина соответствует 0°С.
= k·T Т = = = 273,15 К
Сравнение шкал Цельсия и Кельвина:

(1К и 1°С совпадают, поэтому любое значение абсолютной температуры Т будет на 273° выше соответствующей температуры по Цельсию):
Т = t + 273
Дано:
t1 = 21°C Т1 = 294 К
t2 = 234°C Т2 = 507 К
t3 = -17°C Т3 = -17°С + 273 = 256 К
2. Известно, что
= k·T (ΙΙ)
кин = k·T кин = k·T
= кин (Ι)
Из формулы видно:
Средняя кинетическая энергия поступательного движения молекул пропорциональна абсолютной температуре.
Вывод: Температура есть мера средней кинетической энергии поступательного движения молекул.
3. Известно, что р = пкин - основное уравнение МКТ.
р = пкин = р = п· k·T = пkT
(4) р = пkT - Основное уравнение МКТ
что, при одинаковых p и T, n молекул у всех газов одна и та же.
Закон Авогадро (химия-9): в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
III. Этап обобщения и систематизации изученного.
Из множества процессов, происходящими с газами, для нас наиболее интересны изопроцессы а все газовые законы, открытые экспериментально легко получить из уравнения Менделеева-Клапейрона.
1). Вспомним (к доске приглашаются учащиеся для устных ответов):
-
Уравнение состояния идеального газа.
-
Изотермический процесс.
-
Изобарный процесс.
-
Изохорный процесс.
-
Закон Дальтона.
2). К доске приглашаются учащиеся для решения задач:
Задача 1.
Газ изотермически сжат от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на ∆p = 4·103 Па. Определите первоначальное давление.
Задача 2.
Электрическая лампа наполнена азотом при давлении p1 = 600 мм рт. ст. Объем лампы V = 500 см3. Какая масса воды войдет в лампу, если под водой у нее отломить кончик при давлении p2 = 760 мм рт. ст?
Задача 3.
Идеальный газ расширяется по закону pV2 = const, где p - давление газа; V- занимаемый им объем. Найдите первоначальную температуру газа Т1, если при увеличении его объема в 3 раза температура оказалась равной Т2 = 100 К.
Задача 4.
Изобразите на pV- и pT-диаграммах процесс, происходящий с одним молем идеального газа (рис. 4.18).
Задача5.
Аэростат объемом V = 300 м3 наполняется молекулярным водородом при температуре T = 300 К и давлении p = 105 Па. Какое время будет затрачено на наполнение оболочки аэростата, если из баллонов каждую секунду переходит в аэростат ∆m = 25 г водорода?
IV. Этап информации учащихся о домашнем задании и инструктаж по его выполнению.
§4.4; 4.5-4,6 повторить; знать О.К.
А: Упр 10(2-3);
В: Упр 10(9-13); .
5