- Учителю
- Исследовательская деятельность 'Двуликая вода' (8 класс)
Исследовательская деятельность 'Двуликая вода' (8 класс)











 Содержание
Содержание
Введение стр. 3
1 Теоретическая часть
1.1 Общая характеристика воды стр. 4
1.2 Физико - химические свойства воды стр. 4
1.3 Причины аномального поведения жидкости стр. 8
2 Практическая часть
Микроисследование 1 стр. 11
Микроисследование 2 стр. 12
Микроисследование 3 стр. 12
Микроисследование 4 стр. 13
Заключение стр. 15
Литература стр. 16Введение
Объект исследования: Вода
Основополагающий вопрос: В чем причина аномальных свойств воды?
Цель работы: Рассмотреть физико-химические свойства воды.
Задачи:
1) Изучить литературу по теме.
2) Дать общую характеристику воды.
3) Изучить физико - химические свойства воды
4) Определить роль аномалии воды в биологической жизни на Земле.
5) Проделать опыты, подтверждающие аномальные свойства воды.
Гипотеза: Знание аномальных свойств воды позволят лучше понимать физико-химические процессы, происходящие в организме человека и в живой природе.
Вода играет очень большую роль в жизни всего живого на Земле. Она является средой, в которой протекают все химические превращения, связанные с жизнедеятельностью организмов. Выпитая или поступившая с пищей вода всасывается в желудке и кишечнике, поступает в кровь и ее током распределяется по тканям организма. Только в жидкой водной среде совершаются процессы пищеварения и усвоения пищи в желудочно-кишечном тракте, происходит синтез живого вещества в клетках.
Вода вымывает из клеток отработанные продукты обмена веществ, выносит их из организма, главным образом через почки (с мочой) или через кожу (с потом). Она выполняет также важную механическую роль, облегчая скольжение трущихся поверхностей: суставов, связок, мышц и.т.д.
1 Теоретическая часть
-
Общая характеристика воды.
Вода - бесцветная жидкость, без запаха.
Температура кипения при нормальном атмосферном давлении - 100 °С.
При 4° С плотность воды - 1000 кг\м3
Молекула воды уникальна. Формула ее наверняка всем известна: Н2О. но вот некоторые свойства воды напрямую зависят от строения ее молекулы.
В природе вода существует сразу в трех агрегатных состояниях. При нормальных условиях это жидкое вещество без цвета, запаха и вкуса. При падении температуры вода кристаллизуется и превращается в лед. При повышении температуры жидкость переходит в газообразное состояние - водяной пар.
Вода характеризуется высокой плотностью, которая составляет примерно 1 г/см³. Кипение воды наступает при повышении температуры до 100ºС. А вот при падении температуры до 0ºС жидкость превращается в лед.
Интересно, что снижение атмосферного давления вызывает изменение данных показателей - вода закипает при меньшей температуре.
Теплопроводность воды составляет примерно 0,58 Вт/(м∙К). Еще один важный показатель - это ее высокое поверхностное натяжение, которое практически равно соответствующему показателю у ртути.
1.2 Физико - химические свойства воды.
Изучение физических свойств воды началось в 17 веке, задолго до того, как был определён её химический состав.
А) Вода находится в природе в трех агрегатных состояниях из-за аномалии своих свойств. Известно, что вода кипит 100 ºС, а лед плавится при 0 ºС., Но по химической структуре вода должна бы кипеть, а лед плавиться не при этих температурах, а при очень низких, которых на Земле не бывает. И тогда вода существовала бы в одном агрегатном состоянии - в виде пара, - а ведь жизнь всех живых организмов связана с водой в жидком состоянии! Таким образом, жизнь на Земле появилась благодаря этой аномалии свойств воды. Вода обладает высокой удельной теплоемкостью, которая имеет большое биологическое значение. Вода нагревается впятеро медленнее песка. А чтобы нагреть на 1 ºС литр воды, тепла потребуется в 3300 раз больше, чем для нагрева литра воздуха. Зато, когда вода остывает, она отдает столько же тепла, сколько взяла нагреваясь. Из-за этой исключительной способности воды обитателям водоемов никогда не угрожает ни сильный перегрев, ни чрезмерное охлаждение.
Б) Вода имеет еще очень важную особенность: у нее высокая скрытая теплота испарения и скрытая теплота плавления. Если бы не это свойство воды - медленно испаряться даже в жару - многие водоемы летом быстро бы пересыхали до дна, и вся жизнь в них погибла бы. Замерзая, вода тоже отдает много тепла: 1 л воды, превращаясь в лед, может при охлаждении на 1 ºС подогреть 250 000 л воздуха.
В) Известно, что при замерзании вода расширяется на 11%, именно поэтому лед всегда легче (шестигранные кристаллы природного льда связаны рыхло, между ними много пустот). Лед всплывает вверх, и редкий водоем промерзает до дна. Одновременно лед является хорошим теплоизолятором. «Укутывая» зимой ледяной «шубой» воду, природа сохраняет ее теплой и жидкой, не дает затвердеть. Ведь твердая вода для жизни не пригодна. Если такой процесс происходит в замкнутом пространстве, то возникает громадное избыточное давление, достигающее 2,5 · 108 Па (2500 атм.)! В результате вода, замерзая, разрывает горные породы, дробит многотонные глыбы.
Установившееся мнение о несжимаемости воды справедливо только для сравнительно малых давлений. На поверхности океана плотность воды 1028,13 кг/м3, а на глубине 10000м она уже составляет 1071,04 кг/м3.
Из уроков физики нам стало известно то, что при охлаждении вода сжимается, но достигнув 4 ºС, она начинает уже расширяться, хотя температура и далее понижается. Поэтому вода самая плотная и тяжелая именно при + 4 ºС. Эта аномалия имеет биологическое значение: зимой, охладившись до 4 ºС, вода опускается на дно и здесь сохраняется в течение всей зимы (в пресных водоемах). Охладившиеся сильнее слои воды всплывают, т.к. их плотность и вес меньше. В прямой зависимости от давления находится и температура кипения воды: с увеличением давления она растет. Это свойство раньше использовалось для определения высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворенных веществ.
Ещё один парадокс: с понижением температуры (при повышенном количество теплоты, затрачиваемое на плавление 1 кг льда, падает с каждым градусом на 2,1 кДж. Другими словами, чем холоднее лед, тем проще его растопить давлении!)
Г) Удельная теплота парообразования воды почти в 7 раз выше ее удельной теплоты плавления. Эти свойства воды во многом определяют климат нашей планеты. Для испарения воды с поверхности океана даже в тропиках необходимо значительно больше солнечной энергии, чем для таяния льда. Поэтому круговорот воды, являющийся одним из основных климатообразующих факторов на Земле с ее огромным Мировым океаном и ледниками, весьма специфичен. С ростом температуры вещества его удельная теплоемкость, как правило, возрастает. Но вода и здесь ведет себя особо. Так, с повышением температуры от 0° до 37° удельная теплоемкость воды падает, а в интервале от 37° до 100° С - растет. Поэтому она одинакова, например, при температурах 25° и 45° С, 10° и 74° С. При температуре 37° С реакции обмена веществ происходят наиболее интенсивно, т.е. создается наивыгоднейшее энергетическое состояние для организма.
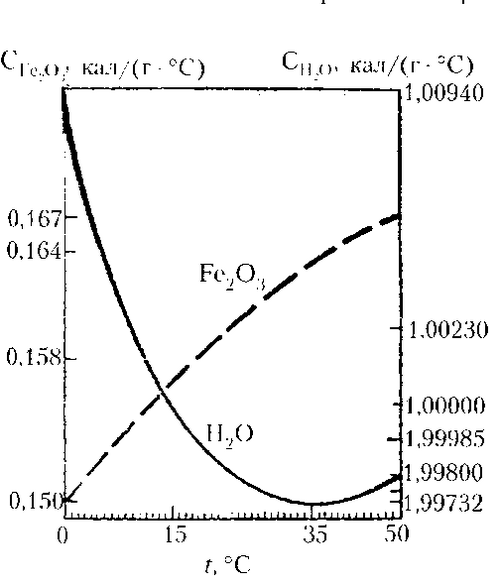
Рисунок 1
Д) Нельзя не обратить внимания на другую немаловажную аномалию воды: у нее из всех жидкостей, кроме ртути, самое большое поверхностное натяжение. Внутри жидкости притяжение молекул друг к другу уравновешено, а на поверхности - нет. Молекулы, которые лежат в глубине, тянут вниз самые верхние молекулы. Поэтому капля и стремится стянуться в узелок. Все мы видели, как по поверхности воды, словно по паркету, бегают насекомые - вертячки и водомерки, - ведь эта поверхность всегда затянута тончайшей пленкой из молекул. За нее цепляются, повиснув вниз головой, личинки комаров и даже ползают улитки с массивными раковинами. Чтобы разорвать эту пленку, нужна немалая сила. Силы поверхностного натяжения тянут вверх воду из глубины почвы, питая растения солями и влагой. Увлекаемая ими, течет она по корням и стеблям самих растений и наполняет кровью наши капилляры.
Е) Структура водной сетки, т.е. взаимное расположение молекул, пока определить экспериментально не удалось (только моделировать); чистой воды в природе нет, а способы ее очистки чрезвычайно сложны; омагниченная вода используется в сельском хозяйстве для повышения урожайности, в технике - для уменьшения накипи в паровых котлах, в магнитобиологии и медицине, но научного обоснования пока нет. Различные изотопы водорода и кислорода способы образовать более 40 различных модификаций воды (часть которых радиоактивна), девять модификаций стабильны и присутствуют в любой воде, но практически в природе преобладает самое обычное соединение протия (Н) и кислорода.
Ж) Физик П. Дебаей облучал каплю воды рентгеновскими лучами и получил так называемую дебаеграмму (картина дифракции рентгеновских лучей в поликристаллах) представляет собой последовательность достаточно резких колец, отвечающих отражению от кристаллических плоскостей, располагающихся под разными углами. Картина дифракции в жидкости - это ряд диффузных ореолов, которые указывают на то, что молекулы в жидкости не обладают так называемым дальним порядком: с увеличением расстояния упорядоченное расположение молекул нарушается, и картина как бы размывается. Такая структура жидкости, открытая П.Дебаем и П. Шерером, получила название ближнего порядка, и это открытие значительно облегчило понимание многих.
1.3 Причины аномального поведения жидкости
Конечно, на сегодняшний день абсолютной ясности пока нет. В свое время алхимики приписывали воде совершенство и поэтому присвоили ей символ в виде равностороннего треугольника вершиной вниз. Оказалось, потом хорошей моделью молекулы является правильный тетраэдр. А началось все около 200 лет назад, когда Генри Кавендиш и Антуан Лавуазье выяснили, что вода - не простой химический элемент, а соединение в определенной пропорции водорода и кислорода. Естественно, что при любой структуре должны существовать какие-то силы, которые связали бы отдельные молекулы в некие комплексы, а последние - в общую массу того, что мы называем собственно водой. «Подобно тому, как кирпичи какого-либо сооружения связаны цементирующим раствором, так и отдельные молекулы связаны друг с другом силами притяжения, называемыми, в частности, водородными связями», - так образно заметил в своей замечательной книге «Мир воды» известный русский гидрогеолог Владимир Дерпгольц.
В конце, концов, молекулы стали изображать тоже в виде треугольника, но равнобедренного. Угол при вершине, где находится атом кислорода, равен 104,5º, а расстояние до каждого из двух атомов водорода 0,96 А (1 A = 10‾10 м). Кроме того, электронная плотность выше в области иона кислорода, поэтому молекула Н2О - полярная, это электрический диполь с «минусом» на атоме кислорода и «плюсом» - на атомах водорода. Будучи диполями, молекулы воды взаимодействуют друг с другом, образуя так называемые водородные связи. Этот тип связи между атомами, промежуточный между ковалентной и невалентной, образуется при наличии атома Н между двумя электроотрицательными атомами, например кислорода: с атомом кислорода в своей молекуле атом водорода связан ковалентной связью, а с атомом кислорода в соседней - водородной.
Что такое водородная связь между молекулами? Поскольку молекула воды несимметрична (оба атома водорода ковалентными связями «прилеплены» к одному боку кислорода), в ней возникает небольшое пространственное разделение электростатических зарядов. Молекула становится диполем: один ее полюс (где атом кислорода) заряжен отрицательно, а другой (где атомы водорода) - положительно.
Электростатическое взаимодействие между молекулами, условно говоря, отрицательным зарядом атома кислорода одной молекулы воды и положительным зарядом атома водорода соседней молекулы и приводит к образованию водородной связи. Каждая молекула воды с помощью водородных связей стремится
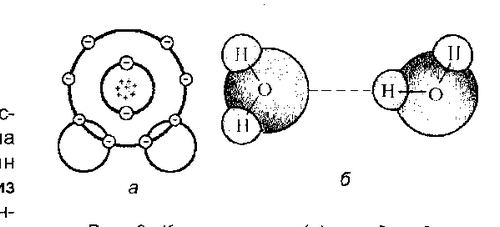
Рисунок 2
связаться с четырьмя соседними молекулами, которые располагаются в вершинах воображаемого тетраэдра на расстоянии примерно 0,276 нм от этой центральной молекулы.
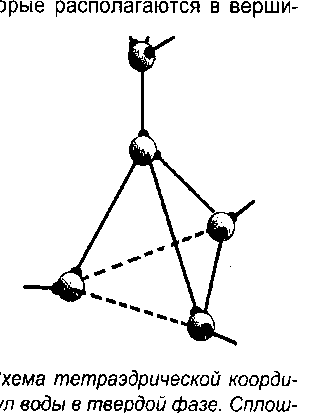
Рисунок 3
Следует отметить, что водородная связь между молекулами воды в 24 раза слабее, чем ковалентная связь в самой молекуле между атомами водорода и кислорода.
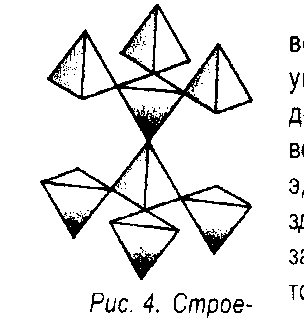
Рисунок 4
Таким образом, модель молекулы воды - правильный тетраэдр, в центре которого находится атом кислорода, в двух вершинах - по атому водорода (из - за смещения плотности электронного облака в сторону более электроотрицательного атома кислорода, заряд каждого атома эквивалентен положительному точечному заряду, численно равному примерно 0,2 заряда электрона, а в направлении двух оставшихся вершин вытянулись еще две электронные орбиты. В целом молекула является электрически нейтральной. Углы между каждой парой линий, соединяющих центр атома кислорода с вершинами тетраэдра, равны 109,5º (тетраэдрические углы).
Вывод: Основная причина аномального поведения воды и проявление её удивительных свойств заключается во внутреннем строении молекулы и соотношении водородной и ковалентной связи.
2 Практическая часть
Микроисследование №1
Цель: Доказательство малой теплопроводности воды.
Оборудование: Пробирка, таблетка «сухого спирта», лед, спиртовка.


Рисунок 5
На дне пробирки с водой находится кусочек льда. В верхней части пробирку с водой нагреваем сухим горючим, через 20 минут в верхней части появляются пузырьки, и вода закипает.
Вывод: Теплопроводность воды низкая, а механизм конвекции практически не работает. (Теплопроводность воды занимает промежуточное положение между теплопроводностью кирпича и дерева). При естественной конвекции происходит изменение плотности воды, и теплые слои поднимаются именно наверх, поэтому лед и не тает.
Микроисследование №2
Цель: Опыты по наблюдению электропроводимости жидкости: дистиллированной воды, питьевой воды, воды из источника.
Оборудование: Пробирки с жидкостями, электрический тестер, амперметр, два электрода.
-
+
№ п/п
Вода
Сила тока I (А)
Яркость ламп
1
Дистиллированная
-
-
2
Питьевая
0,013
Слабо
3
Вода из источника
0,5
Сильно
А
Рисунок 6 Таблица 1
Вывод: Любой раствор жидкости является проводником тока, а сама дистиллированная вода - диэлектрик (не проводник тока). Чем больше соли в воде, тем проводимость больше.
Микроисследование №3
Цель: Опыты, подтверждающие расширение воды при замерзании.
Оборудование: Ёмкости с водой.

Рисунок 7

Рисунок 8
Вывод: При низких температурах - -20°С, при замерзании воды возникает большое механическое напряжение, которое стекло не выдерживает. Опыт ярко доказывает, что вода при замерзании расширяется.
Микроисследование №4
Цель: Опыты, подтверждающие проявление силы поверхностного натяжения.
Оборудование: Ёмкости с водой, игла, капилляр.

Рисунок 9

Рисунок 10

Рисунок 11
Вывод: Капля воды ведет себя, как резиновый мешочек с жидкостью; не только мелкие предмет: пылинки и соринки удерживаются на поверхности воды, но и металлическая игла.
Заключение
Весь мировой океан - это глобальный термостат, который сглаживает колебания температуры, причем как суточные, так и годовые. Кстати, этими же свойствами наделен и водяной пар, который содержится в атмосфере. Ни для кого не секрет, что для пустыни характерны резкие температурные изменения - днем слишком жарко, а в ночное время очень холодно. Это связано как раз с сухим воздухом и отсутствием необходимого количества водяного пара.
Изучив, физико-химические свойства воды, мы пришли к выводу: основная причина аномального поведения воды и проявления её удивительных свойств заключается во внутреннем строении молекулы и соотношении водородной и ковалентной связи. В молекуле воды господствует ковалентная связь, и эта молекула является хорошим электрическим диполем.
Поэтому вода - лучший в мире растворитель! Она растворяет очень многие вещества, но сама при этом остается инертной, ее свойства мало изменяются от растворяемых веществ. Все растворы, циркулирующие в живых организмах, - водные. Именно благодаря этому свойству вода и смогла стать носителем жизни.
Литература
-
В.А. Чуянов - Энциклопедический словарь юного физика.
-
Ф.Д. Бублейников - Физика и опыт.
-
Л.И. Перельман - Занимательная физика.
-
О.С. Габриелян - Химия. 8 класс.
-
А.П. Перышкин - Физика. 8 класс.
-
Журнал «Физика». М:, «Первое сентября». 2007 г.
-
Журнал «Физика». М:, «Первое сентября». 2007 г.
16