- Учителю
- Конспект урока Применение 1 закона термодинамики к изопроцессам
Конспект урока Применение 1 закона термодинамики к изопроцессам
Урок Применение первого закона термодинамики к изопроцессам
Цель урока: рассмотреть изопроцессы в газах с энергетической точки зрения, применив к ним первый закон термодинамики; рассмотреть адиабатический процесс; применение адиабатного процесса в технике, проявление адиабатного процесса в природных явлениях; закрепить знания, полученные при изучении нового материала.
Методические цели урока:
Образовательные: обеспечить в ходе урока усвоение следующих основных понятий: адиабатное расширение и сжатие; сформировать умения учебно-познавательного характера для установления связи между первым законом термодинамики и изопроцессами.
Развивающие: формировать умение логически рассуждать; кратко и исчерпывающе излагать свои мысли; формировать способность наблюдать эксперимент, выделять существенные признаки объектов, выдвигать гипотезы.
Воспитательные: содействовать в ходе занятий формированию основных мировоззренческих идей о материальности мира, познаваемости мира и его закономерностей; формировать интерес к предмету.
Тип урока: урок изучения и первичного закрепления новых знаний.
Ход урока
-
Организационный этап
Приветствие учителя. Подготовка учащихся к работе на уроке: готовность класса и оборудования. Проверка наличия учебных принадлежностей. Проверка присутствующих. Запись домашнего задания.
2. Повторение изученного материала
Проверка письменного домашнего задания:
Р. № 627, 628.
3. Этап актуализации знаний 
Фронтальный опрос
-
Чему равна внутренняя энергия идеального одноатомного газа?
-
Назовите два способа изменения внутренней энергии?
-
Как рассчитать работу газа?
-
Что называют количеством теплоты?
-
Сформулируйте 1 закон термодинамики
4. Этап постановки целей и задач урока
Проблемная ситуация.
Из формулировки первого закона термодинамики следует, что изменение внутренней энергии системы может происходить за счёт совершения работы и количества теплоты, переданного системе. Обратимся к формулам, которые используют для определения внутренней энергии, количества теплоты, работы газа.
-
От каких величин зависит внутренняя энергия газа? (от объёма и температуры)
-
От каких величин зависит количество теплоты, переданное газу? (от изменения температуры)
-
От каких величин зависит работа газа? (от изменения объёма и давления)
-
Как вы считаете, будет ли изменяться первый закон термодинамики, если мы будем рассматривать его с учётом параметров (давление, объём, температура), которые могут не изменяться?
-
Как называются законы, в которых есть неизменный макропараметр? (закон Бойля-Мариотта, закон Шарля, закон Гей-Люссака)
Можно сделать вывод на основании ваших ответов: первый закон термодинамики будет изменяться, в зависимости от изопроцессов, происходящих с газом.
Как вы думаете, какая тема нашего урока? «Применение первого закона термодинамики к изопроцессам».
Откройте свои рабочие тетради и запишите тему сегодняшнего урока «Применение первого закона термодинамики к изопроцессам».
Как вы думаете, какая цель будет стоять перед нами на этом уроке?
Цель, которую мы ставим сегодня перед собой: рассмотреть изопроцессы в газах, применив к ним первый закон термодинамики; рассмотреть адиабатический процесс и его использование на практике и проявление в природных явлениях; закрепить знания, полученные при изучении нового материала.
5. Этап усвоение новых знаний и способов действий
Каждому ученику для работы на уроке выдаётся шаблон таблицы «Применение первого закона термодинамики к изопроцессам», который заполнен частично: графики изопроцессов и примеры. Такие графы, как «Запись закона», «Изменение внутренней энергии», «Физический смысл первого закона термодинамики» ученики заполняют по мере выполнения задания.
Для изучения новой темы весь класс разделится на три группы:
1 группа рассматривает первый закон термодинамики для изохорного процесса. С этой целью вы решаете задачу, по решению делаете вывод о том, как изменился первый закон термодинамики, а затем, полученный результат заносите в таблицу, и записываете физический смысл первого закона термодинамики для изохорного процесса.
Задача №1.
При изохорном нагревании газу было передано от нагревателя количество теплоты 250Дж. Какую работу совершил газ? Чему равно изменение внутренней энергии газа?Дано:
V=const
Q=250Дж
Решение:
ΔU = Q-АI, =>, Q = ΔU +АI
т.к. АI=p∙ΔV, по условию задачиV=const, ΔV=0, =>, АI=0, тогда 1 закон термодинамики примет вид: Q = ΔU, =>, ΔU=250 (Дж)
Внутренняя энергия газа увеличивается за счёт подводимого тепла.
АI -?
ΔU -?
Задача №2.
При изохорном охлаждении внутренняя энергия газа уменьшилась на 350Дж. Какую работу совершил газ? Какое количество теплоты было передано газом окружающим телам?Дано:
V=const
ΔU=350Дж
Решение:
ΔU = Q-АI, =>, Q = ΔU +АI
т.к. АI=p∙ΔV, по условию задачиV=const, ΔV=0, =>, АI=0, тогда 1 закон термодинамики примет вид: -Q = ΔU, =>, Q=-350 (Дж)
Внутренняя энергия газа уменьшается за счёт того, что газ отдаёт тепло окружающей среде.
АI -?
Q-?
2 группа рассматривает первый закон термодинамики для изотермического процесса. Вам предстоит решить задачу, на основе решенияделаете вывод о том, как изменился первый закон термодинамики, затем в таблицу заносите полученную формулу и записываете физический смысл первого закона термодинамики для изотермического процесса.
Задача №3.
При изотермическом сжатии газ передал окружающим телам теплоту 800Дж. Какую работу совершил газ? Какую работу совершили внешние силы?
Дано:
T=const
Q=800Дж
Решение:
ΔU = Q+А
т.к. ΔU =, по условию задачи T=const, ΔT=0, =>,ΔU=0;
газ сжимают, значит, внешние силы совершают положительную работу, а сам газ совершает отрицательную работу;
тогда 1 закон термодинамики примет вид:Q = -А, =>,Q =АI,
А =-800 (Дж); АI= 800(Дж)
При совершении работы внешними силами газ отдаёт тепло окружающей среде.
АI -?
А-?
3 группа по учебнику (§79, с. 219) изучает
первый закон термодинамики для изобарного процесса. В таблицу
записываете закон, формулы и физический смысл первого закона
термодинамики для изобарного процесса, используя материал
параграфа.
6. Этап обобщения нового материала
При подведении итогов каждая группа рассказывает о результатах, остальные ученики заполняют таблицу.
Для проверки таблицы от каждой группы вызывается ученик, который заполняет таблицу: записывает закон, формулы и физический смысл первого закона термодинамики для изохорного, изотермического, изобарного процесса:
Название
процесса
График
Запись
закона
Изменение
внутренней
энергии
Физический смысл записи
первого закона термодинамики
Примеры
Изохорный процесс
V=const
нагревание Q>0, A=0
p 2
Q
1
V
ΔU=Q
ΔU>0
Внутренняя энергия газа увеличивается за счёт подводимого тепла
Нагрев воды в чайнике; нагрев воздуха в комнате; получение планетой Земля энергии от Солнца
охлаждение Q<0, A=0
p 1
Q
2
V
ΔU= -Q
ΔU<0
Внутренняя энергия газа уменьшается за счёт того, что газ отдаёт тепло окружающей среде
Изотермический процесс
T=const
расширение AI>0, Q>0
p 1
Q
2
V
Q= AI
ΔU=0
Все переданное газу тепло идёт на совершение им же работы
«Вечный двигатель» - не вечен, т.к. для совершения работы необходимо поступление количества теплоты Q. При отсутствии этого поступления работа совершается за счёт убыли внутренней энергии до 0.
сжатие AI< 0, Q< 0
p 2
Q
1
V
0=- Q +A
ΔU=0
При совершении работы внешними силами газ отдаёт тепло окружающей среде
Изобарный процесс
p=const
нагревание (расширение)
AI>0, Q>0
P Q
-
2
V
Q= ΔU+AI
ΔU>0
Подводимое к газу тепло идёт на увеличение его внутренней энергии и на совершение газом работы
Двигатели смешанного типа
охлаждение (сжатие)
AI< 0, Q< 0
p
Q
-
1
V
ΔU = -AI- Q
ΔU = A- Q
ΔU<0
Внутренняя энергия уменьшается за счёт того, что над газом совершается работа и газ отдаёт тепло окружающей среде
Адиабатный процесс
Q=const
расширение AI>0, Q=0
p 1
T=const
2
V
0= -ΔU+AI ΔU= - AI
ΔU<0
Внутренняя энергия газа уменьшается за счёт того, что сам газ совершает работу, газ охлаждается
Нагрев насоса при накачивании шины; вспыхивание смоченной эфиром ватки при резком вдвигании поршня в сосуд; охлаждение и конденсация пара в облаке при его быстром поднятии вверх и резком расширении в атмосфере - объяснение образования облаков в атмосфере Земли; рабочий ход ДВС
сжатие AI<0,Q =0
p
2
T=const
1
V
ΔU = A
ΔU>0
Внутренняя энергия газа увеличивается за счёт того, что внешние силы совершают над газом работу, газ нагревается
Два ученика получили опережающее задание и
расскажут нам об адиабатном процессе, который происходит в
изолированной системе, т.е. система не обменивается теплом с
окружающими телами (при Q=0). 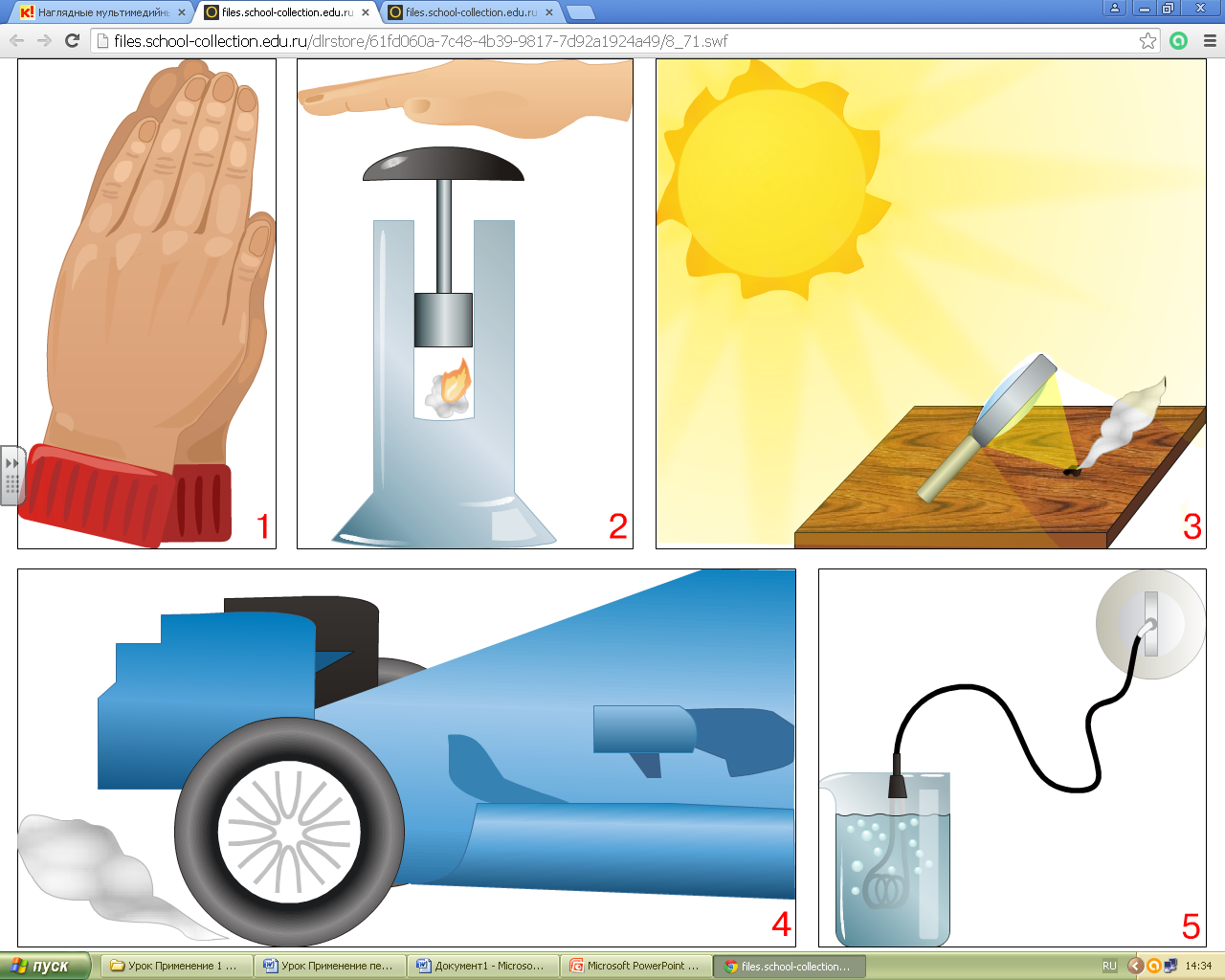
Мы понимаем, что окружить систему оболочкой, которая бы не допускала теплообмен нельзя. Но если реальные процессы будут происходить очень быстро, чтобы за это время не возникала теплопередача, то их можно считать адиабатными.
На основе уравнения ΔU = A можно сделать вывод о том, что при сжатии газа его внутренняя энергия увеличивается, а внешние силы совершают положительную работу.
Если газ расширяется и сам совершает работу, то его внутренняя энергия уменьшается, а газ - охлаждается.
Рассмотреть примеры адиабатных процессов в природе и технике: работа двигателя внутреннего сгорания, работа компрессоров, сжимающих воздух - адиабатное сжатие. В качестве демонстрации используется видео опыта «Воздушное огниво»; образование облаков - адиабатное расширение можно рассмотреть с помощью видео опыта «Образование тумана».
Для закрепления материала об адиабатном процессе решить задачу.
Задача №4.
При адиабатном сжатии газа была совершена работа 200Дж. Как и насколько изменилась при этом внутренняя энергия газа?Дано:
Q =const
А =200Дж
Решение:
ΔU = Q+А, по условию задачи Q=const, тогда 1 закон термодинамики примет вид:ΔU = А,
ΔU =200 (Дж)
При совершении работы внешними силами газ отдаёт тепло окружающей среде.
ΔU -?
Рассмотреть примеры использования первого закона термодинамики в практической жизни человека и в природе с использованием таблицы.
-
Этап закрепления нового материала
Решение задач
Объём кислорода массой 160г, температура которого 27°С, при изобарном нагревании увеличился вдвое. Найдите работу газа при расширении, количество теплоты, которое пошло на нагревание кислорода, изменение внутренней энергии.
Дано:
T=300К
p=const
V2= 2∙V1
m=0,16кг
М=32∙10-3
Решение:
Q = ΔU +АI
АI=p∙ΔV= p∙(V2-V1)= p∙V1, p∙V1=, =>, АI=
т.к. это двухатомный газ, тоΔU = ∙ = ∙p∙V1= ∙АI
Q = ΔU +АI = ∙АI+АI =∙АI
АI==12465 (Дж)
ΔU=∙12465= 31162,5 (Дж)
Q = ∙12465 = 43627,5 (Дж)
АI- ?
Q - ?
ΔU - ?
Вопросы на слайде:
-
Изменять внутреннюю энергию теплообменом - это ...
-
Изменять внутреннюю энергию действием силы, то же, что и ...
-
Как называются способы изменения внутренней энергии тел?
-
В формуле ΔU = Q + A слева находится ...
-
Сформулируйте первый закон термодинамики.
-
Запись Q = 0 означает, что ...
-
Итоговый вид записи A = ΔU означает, что ...
-
Формулу первого этапа ΔU = 0 + A мы записали ...
-
Запись ΔU > 0 означает, что ...
-
Запись A = 0 означает, что ...
-
Перед Q стоит знак минус, так как ...
-
Величина ΔU меньше нуля, так как ...
-
Это означает, что ...
-
ЗаписьΔU = -A означает, что величина ΔU ...
-
Запись ΔU < 0 означает, что ...
-
Контроль и самопроверка знаний
Выполнение теста: один ученик выполняет тест «Изменение внутренней энергии» на интерактивной доске, остальные ученики выполняют тест «Основы термодинамики».
Тест по теме «Основы термодинамики»
1.Чем определяется внутренняя энергия тела?
А.Скоростью движения и массой тела.
Б.Энергией беспорядочного движения частиц, из которых состоит тело.
В.Энергией беспорядочного движения частиц и энергией их взаимодействия.
Г. Энергией взаимодействия частиц, из которых состоит тело.
2.В каком случае может измениться внутренняя энергия тела?
А.Только при совершении работы.
Б.Только при нагревании.
В.Только при теплопередаче.
Г.При совершении работы и теплообмене.
3.Как изменяется внутренняя энергия тела при переходе из твёрдого состояния в жидкость при постоянной температуре?
А.Остаётся постоянной.
Б.Может увеличиваться или уменьшаться в зависимости от внешних условий.
В.Уменьшаться.
Г.Увеличиваться.
4.По какой формуле определяется внутренняя энергия идеального газа?
А. . Б.RT. В.. Г..
5. По какой формуле определяется при адиабатном процессе?
А.. Б.. В.. Г..
6. По какой формуле определяется при изохорном процессе?
А.. Б.. В.. Г..
7. По какой формуле определяется при изобарном процессе?
А.. Б.. В.. Г..
8.Какая формула соответствует первому закону термодинамики?
А.. Б.. В.. Г..
9.По какой формуле определяется количество теплоты при парообразовании?
А. Б.. В.. Г..
10.По какой формуле определяется количество теплоты при нагревании тела?
А. Б.. В.. Г..
Использование презентации: ученики осуществляют взаимопроверку результатов по правильным ответам, которые выведены на слайд.1
2
3
4
5
6
7
8
9
10
В
Г
Г
Б
В
Г
Б
Б
Б
А
9. Рефлексия
-
</ Какую цель мы поставили перед собой на урок?
-
Достигли ли Вы тех целей, которые поставили в начале урока?
-
А теперь давайте выставим оценки.
Домашнее задание:
§79, упр. 15(7,8) - для всех учеников;
Р*. № 633 - индивидуальное задание (для тех, кто полностью разобрался с изученным материалом)