- Учителю
- План-конспект урока №3 Электрический ток в жидкости.
План-конспект урока №3 Электрический ток в жидкости.
Урок №3. Электрический ток в жидкостях.
Задачи урока:
-
изучить механизм образования свободных зарядов в расплавах и растворах электролитов;
-
исследовать зависимость сопротивление электролита от температуры;
-
познакомиться с применением электролиза в техники.
План урока
1. Повторение изученного материала.
2. Самоконтроль №1 "Проверь, как изучил материал"
3. Изучение нового материала.
4. Самоконтроль №2 "Проверь, как понял теорию"
5. Итоги урока.
6. Домашнее задание
Повторение. «Проверь, как изучил материал!».
О![]() тветь на
поставленные вопросы, результат запиши в тетрадь!
тветь на
поставленные вопросы, результат запиши в тетрадь!
-
Какой процесс называется электролитической диссоциацией?,
-
Как образуются свободные заряды в растворах и расплавах электролитов?
Выполни задачу, оформив решение в тетради!
Объясните, что произойдёт с показанием гальванометра при нагревании раствора медного купороса?
Ход урока.
Электрический ток в жидкостях.
Жидкости могут быть диэлектриками (дистиллированная вода), проводниками (расплавленное стекло, растворы солей, щелочей и кислот) и полупроводниками (расплавленный селен, расплавы сульфидов).
Носителями заряда в водных растворах и расплавах электролитов являются положительные и отрицательно заряженные ионы, поэтому такую проводимость называют ионной.
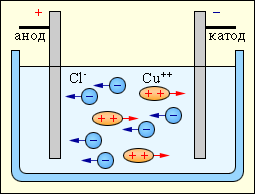
При ионной проводимости прохождение тока связано с переносом ионов вещества и на электродах происходит выделение веществ, входящих в состав электролитов. Например, при прохождении электрического тока через водный раствор хлорида меди у положительного электрода (анода) выделяется газообразный хлор, а на отрицательном электроде (катоде) выделяется медь.
Процесс выделения вещества, связанный с окислительно-восстановительными реакциями называют электролизом.
Интересным является тот факт, что сопротивление электролитов с ростом температуры уменьшается.
Явление электролиза широко применяется в современном промышленном производстве. С помощью электролиза из солей и оксидов получают медь, алюминий, никель. Он используется при нанесении тонких слоев никеля, серебра, золота на поверхность изделий из других металлов. На основе данного процесса Б.С. Якоби был разработан метод изготовления полых фигур (гальванопластика) при создании скульптур Исаакиевского собора в Санкт-Петербурге.
Электрический ток в электролитах. Законы электролиза.
Электролиты - растворы кислот, солей, щёлочей, а также расплавы металлов.
Электролитическая диссоциация, это распад молекул на составляющие ионы.
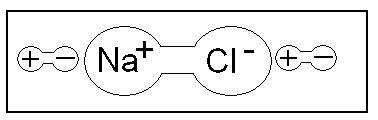
NaCl à Na+ + Cl-
Рекомбинация - восстановление молекулы
Na+ + Cl- à NaCl
При неизменных внешних условиях динамическое равновесие:
NaCl à ß Na+ + Cl- ; CuSO4 à ß Cu 2+ + SO42-
Ток в электролите - упорядоченное движение ионов.
2. Ток сопровождается переносом вещества. Выделение вещества на электродах в результате ОВР (окислительно-восстановительная реакция) при протекании тока называется электролизом.
Природа тока в жидкостях. Электрический ток в растворах (расплавах) электролитов - направленное движение положительных и отрицательных ионов (ионная проводимость). При ионной проводимости прохождение тока сопровождается выделением на электродах веществ, входящих в состав электролитов. Этот процесс широко применяется в технике и называется электролизом. Сопротивление электролитов падает с повышением температуры из-за увеличения числа ионов в растворе. Для электролитов справедлив закон Ома.
Законы электролиза (законы Фарадея).
Первый закон Фарадея. Масса вещества, выделившегося на электроде, прямо пропорциональна общему заряду, прошедшему через электролит:
![]()
Второй закон Фарадея: 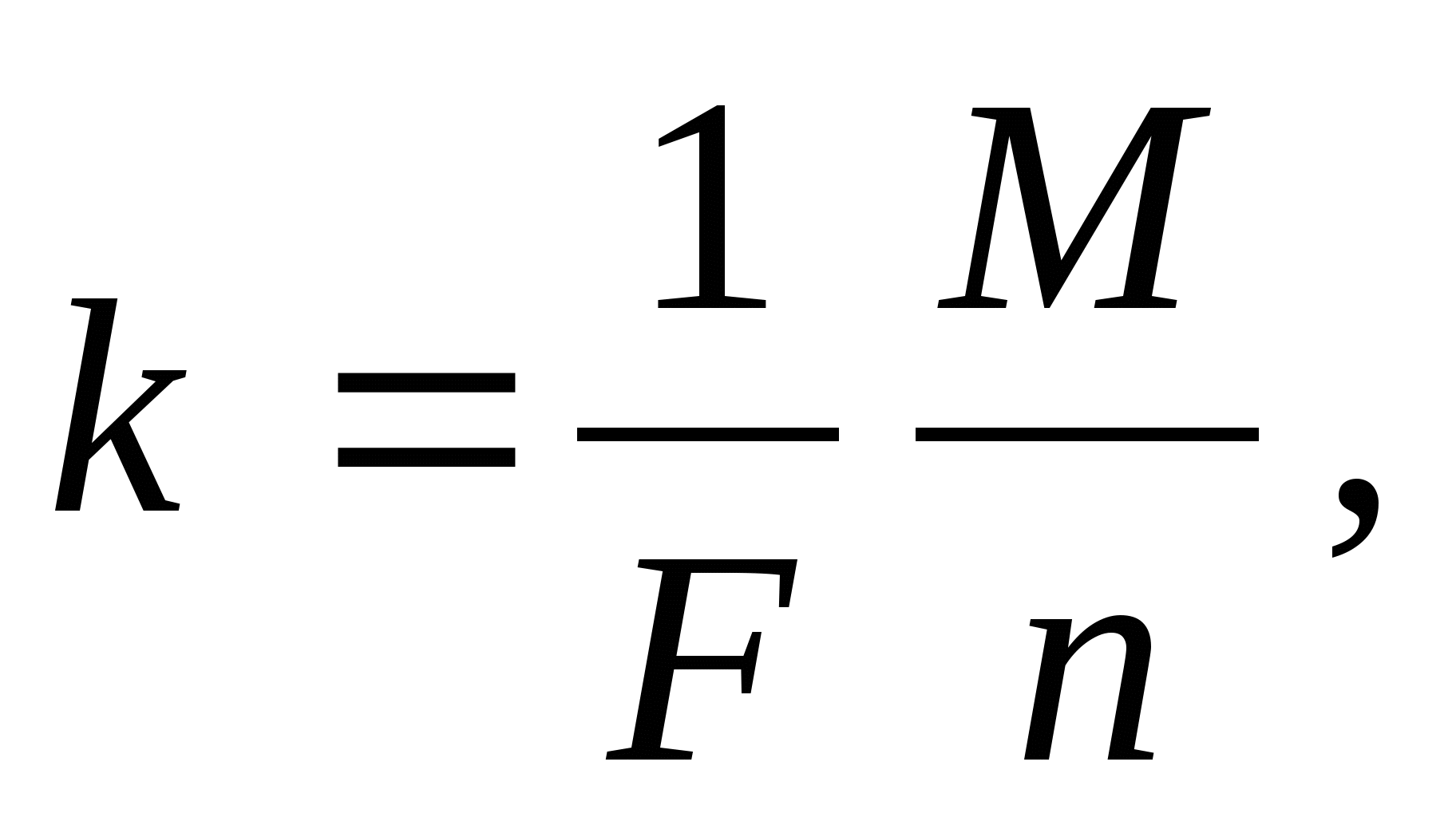 где F =
9,648 . 104 Кл/моль - постоянная Фарадея,
где F =
9,648 . 104 Кл/моль - постоянная Фарадея,
М - молярная масса, n - валентность вещества, в растворе (расплаве) которого происходит электролиз.
Объединенный закон электролиза: 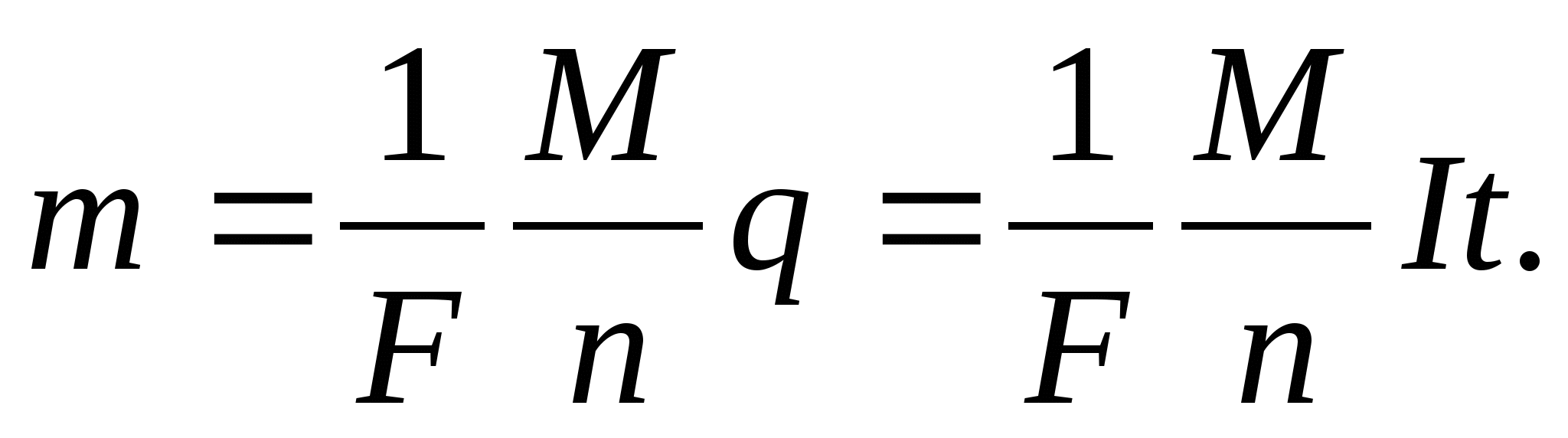
Получим выражение для расчета массы вещества, выделившегося на электроде.
3. m = mоi Ni, (1)
где mоi - масса иона; Ni - число ионов, достигших электрода.
![]() (2),
(2),
где µ - молярная масса; NA - число Авогадро
![]() (3),
(3),
Так как ∆q = J · ∆t; qi = n e, где qi - заряд ; n - валентность; e - элементарный заряд, то формула (3) примет вид:
![]() (4)
(4)
Формула (2) и (4) подставим в выражение (1) и получим:
![]() (5) - закон
электролиза
(5) - закон
электролиза
![]() - величина
постоянная для данного вещества. Химический эквивалент вещества:
- величина
постоянная для данного вещества. Химический эквивалент вещества:
![]() .
.
![]() -
электрохимический эквивалент вещества. NАe = F = 96480
Кл/моль - число Фарадея
-
электрохимический эквивалент вещества. NАe = F = 96480
Кл/моль - число Фарадея
![]() ,
,![]() .
Электрохимический эквивалент вещества прямо пропорционален его
химическому эквиваленту. Формула (5) примет вид m = kID t или m=kDq
(6). Масса вещества выделившегося на электроде прямо
пропорциональна заряду, прошедшему через электролит.
.
Электрохимический эквивалент вещества прямо пропорционален его
химическому эквиваленту. Формула (5) примет вид m = kID t или m=kDq
(6). Масса вещества выделившегося на электроде прямо
пропорциональна заряду, прошедшему через электролит.
Из формулы (6) вытекает физический смысл k:k=m,
Электрохимический эквивалент показывает массу вещества, которая выделится на электроде при протекании через электролит заряда в 1 Кл.
Так как ![]() и
и ![]() , то
F = ∆q , если ∆q =1 Кл.
, то
F = ∆q , если ∆q =1 Кл.
при ![]() . Число
Фарадея характеризует величину заряда при прохождении которого на
электроде выделяется вещество, масса которого численно равна его
химическому эквиваленту.
. Число
Фарадея характеризует величину заряда при прохождении которого на
электроде выделяется вещество, масса которого численно равна его
химическому эквиваленту.
Используя формулу (5), опытным путем находят элементарный заряд:
![]() .
.
Область применения электролиза:
получение чистых металлов: рафинирование меди, добыча алюминия из бокситов;
гальваностегия - покрытие поверхности тонким слоем неокисляющегося вещества (серебрение, никилирование и т.п.);
гальванопластика - получение отслаивающихся покрытий с поверхностей с целью воспроизведения их формы.
Вопрос?
Электролитом является...![]()
-
Кремний
-
Дерево.
-
Раствор медного купороса
-
эбонит

Домашние задание:
Учебник: Г. Я. Мякишев и др. Физика: 10-11 кл, Электродинамика. М-2006.
-
§ 3.4 - 3.5, стр.265
-
§ 3.21. Примеры решения задач, стр. 329