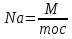- Учителю
- Макроскопическая система и ее характеристики. Атомы и молекулы. 10 класс
Макроскопическая система и ее характеристики. Атомы и молекулы. 10 класс
МАКРОСКОПИЧЕСКАЯ СИСТЕМА И ХАРАКТЕРИСТИКИ ЕЕ СОСТОЯНИЯ. АТОМЫ И МОЛЕКУЛЫ, ИХ ХАРАКТЕРИСТИКИ
Любое тело - твердое, жидкое, газообразное - состоит из огромного числа частиц, которые находятся в непрерывном, хаотическом движении и взаимодействуют между собой.
Тела, состоящие из очень большого числа частиц: атомов, молекул, ионов, называют макроскопическими телами или макроскопическими системами.
Примеры:
газ в баллоне, жидкость в сосуде, твердое тело
Молекулярная физика - раздел физики, в котором изучают физические свойства макроскопических тел в различных агрегатных состояниях на основе рассмотрения их внутреннего строения.
Состояние механической системы характеризуется параметрами состояния, к которым относятся координата и импульс. При изменении состояния системы параметры изменяются. Их значение в любой момент времени можно однозначно определить, если известны параметры начального состояния системы и закон их изменения.
Пример:
если поставить на включенную плиту сосуд с водой, то состояние системы «сосуд-вода» начнет изменяться; через некоторое время сосуд и вода нагреются, их объемы увеличатся.
Параметры состояния системы, которые характеризуют состояние системы как целого - объем, давление, температура.
В основе молекулярной физики лежат 2 теории: термодинамика и МКТ.
-
Положения МКТ
-
Все вещества состоят из частиц, между которыми есть промежутки
-
Частицы вещества находятся в непрерывном хаотическом движении
-
Частицы вещества взаимодействуют между собой; между ними действуют силы притяжения и отталкивания
-
Экспериментальные обоснования существования молекул и атомов
-
Левкипп (5 в до н.э.) и Демокрит (460 -т370 до н.э.) «Идея атомистического строения вещества»
-
М.В. Ломоносов - считал, что все тела состоят из элементов - наименьших неделимых частиц
-
Джон дальтон (1766 - 1844). В 1803 установил закон кратных отношений.
-
Размеры молекул
-
Простейшие молекулы 10^-10 м
-
Органические соединения 10^-9 м
-
Белковые соединения 10^-8,10^-7м
-
Масса молекул
При расчетах часто пользуются понятием относительной молекулярной массы.
Относительная молекулярная масса - величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода.
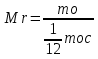
-
Количество вещества
количеством вещества называют величину, равную отношению числа молекул или атомов в данном теле к числу атомов в 0,012 кг углерода.
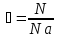
один моль - количество вещества.
-
Молярная масса
Молярная масса - масса количества вещества 1 моль.
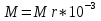
m = Mν
-
Концентрация молекул. Постоянная Авогадро
Число молекул в единице объема называют концентрацией.
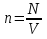
один моль любого вещества содержит одинаковое число молекул. Это число называют постоянной Авогадро.
Постоянная Авогадро - число молекул или атомов в количестве вещества 1 моль.