- Учителю
- Лабораторная работа 2 ИЗМЕРЕНИЕ МОЛЯРНОЙ ГАЗОВОЙ ПОСТОЯННОЙ МЕТОДОМ СРАВНЕНИЯ ДВУХ СОСТОЯНИЙ ГАЗА
Лабораторная работа 2 ИЗМЕРЕНИЕ МОЛЯРНОЙ ГАЗОВОЙ ПОСТОЯННОЙ МЕТОДОМ СРАВНЕНИЯ ДВУХ СОСТОЯНИЙ ГАЗА
Лабораторная работа 2
ИЗМЕРЕНИЕ МОЛЯРНОЙ ГАЗОВОЙ ПОСТОЯННОЙ МЕТОДОМ СРАВНЕНИЯ ДВУХ СОСТОЯНИЙ ГАЗА
Оборудование: шар для взвешивания воздуха с чехлом, резиновым патрубком и винтовым зажимом; термометр лабораторный от 0 до +50 °С с делениями 0,1°С; насос воздушный ручной; весы технические; набор гирь; тройник стеклянный; резиновые трубки.
Предупреждение. В целях безопасности стеклянный шар должен во время работы находиться в матерчатом чехле, затянутом и завязанном шнурком на отростке шара.
Содержание и метод выполнения работы
Универсальную (молярную) газовую постоянную в этой работе определяют из сравнения двух различных состояний воздуха, находящегося в стеклянном шаре. Если в шаре объемом V1 при давлении p1 и температуре Т1 содержится воздух массой m1, то это состояние можно описать уравнением Менделеева- Клапейрона:
![]() (1)
(1)
где М - молярная масса воздуха, R - универсальная газовая постоянная.
Путем откачки или нагнетания воздуха в шар без изменения его температуры можно получить второе состояние, характеризуемое следующими параметрами: m2, p2, V1 и Т1. Уравнение Менделеева - Клапейрона для этого состояния будет таким:
![]() (2)
(2)
где m2 - масса новой порции воздуха в шаре, a p2 - его давление. Вычитая из равенства (2) равенство (1) и учитывая, что объем воздуха и его температура во время опыта оставались постоянными, получим:
![]()
отсюда универсальная газовая постоянная будет равна
![]()
Здесь М = 29 кг/моль; объем V1 обозначен на стенке шара; температуру Т1 воздуха в помещении измеряют с помощью термометра; давления р1 и р2 воздуха в шаре измеряют манометром. При этом следует учесть, что манометр измеряет избыточное давление в технических атмосферах, а 1 ат= 105 Па. Поэтому обозначениям шкалы -1; -0,5; 0; 0,5; 1; 1,5 ат соответствуют давления 0; 0,5; 1; 1,5; 2; 2,5 ат или 0; 0,5·105; 105; 1,5·105; 2·105; 2,5·105 Па.
Для определения разности масс m2 - m1 достаточно произвести два взвешивания (измерить массу шара с воздухом для одного и другого состояний) и найти разность между результатами взвешиваний.
Порядок выполнения работы
1) Подготовьте в тетради две таблицы для записи результатов измерений и вычислений:
1
2
3
4
р, 105 Па
m, 10-3 кг
1-2
1-3
1-4
2-3
2-4
3-4
R, 103
2) Соберите установку по рисунку 1. С помощью резиновых трубок и стеклянного тройника соедините шар с манометром и откачивающим патрубком насоса.
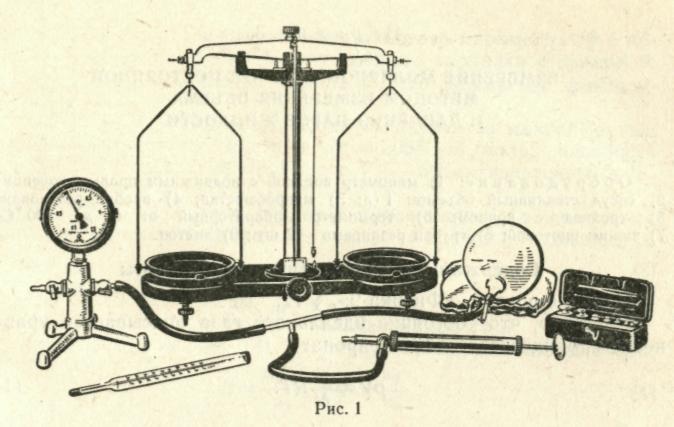
3) Медленно откачивая воздух, доведите давление до 0,5·105Па.
4) Зажмите резиновый патрубок шара винтовым зажимом, от соедините шар от установки и взвесьте его.
5) Для получения второго состояния воздуха отпустите зажим, соединив шар с атмосферой. Затем подключите шар к установке, переставьте резиновую трубку с разрежающего патрубка насоса нагнетающий и доведите давление до 105 Па по манометру.
6) Вновь сожмите патрубок шара винтовым зажимом, отсоедините шар от установки и взвесьте его.
7) Опыт повторите еще два раза, увеличивая каждый раз давление на 0,5• 105 Па.
8) Запишите в таблицу 1 результаты измерений.
9) Измерьте температуру Т воздуха в помещении и найдите на стенке шара число, обозначающее его объем V1. Вычислите постоянное для всех опытов выражение
10) Пользуясь данными таблицы 1, вычислите числовое значение универсальной газовой постоянной для любых двух состояний по формуле
![]()
11) Результаты вычислений запишите в таблицу 2.
12) Вычислите для R среднее числовое значение и определите абсолютную погрешность результата.
Контрольные вопросы
1) Какая из измеряемых величин более всего влияет на относительную погрешность?
2) Каков физический смысл универсальной газовой постоянной?
3) Как, не дожидаясь полного успокоения коромысла весов, Определить их нулевую точку