- Учителю
- ФУНДАМЕНТАЛЬНЫХ ОСНОВ КИНЕТИКИ И ТЕРМОДИНАМИКИ ЖИВЫХ СИСТЕМ (11 класс)
ФУНДАМЕНТАЛЬНЫХ ОСНОВ КИНЕТИКИ И ТЕРМОДИНАМИКИ ЖИВЫХ СИСТЕМ (11 класс)
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное
учреждение
высшего профессионального образования
Национальный минерально-сырьевой университет «Горный»
Кафедра безопасности производства
ФУНДАМЕНТАЛЬНЫХ ОСНОВ КИНЕТИКИ И ТЕРМОДИНАМИКИ ЖИВЫХ СИСТЕМ
Методические указания
к самостоятельным работам
Санкт-Петербург
2014
Фундаментальных основ кинетики и термодинамики живых систем: Методические указания к самостоятельным работам / Национальный минерально-сырьевой университет «Горный». Сост.: Х.Ф. Махмудов. СПб, 2014. 50 с.
Изложены фундаментальных основ безопасности живых систем с точки зрении биофизики. Приведены подходы и модели изучении фундаментальных законов живых систем, лежащих в основе биологических процессов.
Табл.12. Ил.39. Библиогр.: 6 назв.
Научный редактор проф. Г.И. Коршунов
ÓНациональный минерально-сырьевой
университет «Горный», 2014
ВЕДЕНИЯ
Биофизика. - Это наука о наиболее фундаментальных законах, лежащих в основе биологических процессов. Предмет Биофизики. - Живые системы. Объект Биофизики. - Живая природа в сравнении с неживой природой.
Высокая упорядоченность живых систем: дискретность и целостность; многоуровневая организация.
Способность к самовоспроизведению.
Способность к развитию в направлении усложнения организации.
Феномен информации.
Феномен целесообразности.
Философская проблема: О возможности сведения всех законов к законам физики.
Редукционизм. Все законы ЖС можно свести к законам физики.
Антиредукционизм, Витализм. Законы ЖС принципиально не сводятся к физическим.
Дополнительность. В основе лежат физические законы, но существуют процессы и явления пока не объяснимые с точки зрения физики и химии.
ХИМИЧЕСКИЕ РЕАКЦИИ, КАК МОДЕЛЬ КИНЕТИЧЕСКИХ ЗАКОНОМЕРНОСТЕЙ.
Кинетическая классификация химических реакций. Особенности кинетики биологических процессов. Примеры кинетических моделей биологических процессов.
Реакции первого порядка.
![]()
![]()
![]()
Реакции второго порядка.
![]()
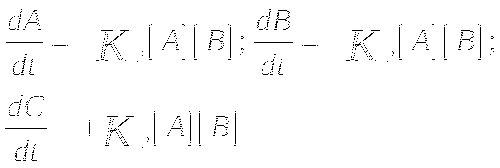
Цепочка реакций.
![]()
![]()
Разветвление цепи.
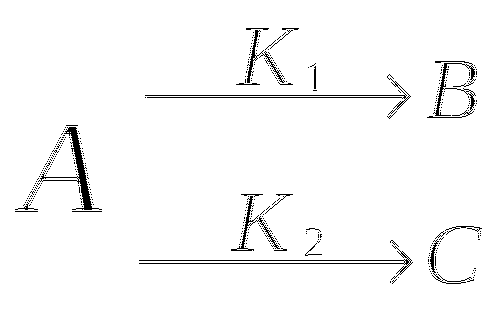
![]()
Реакция с обратной связью.
![]()
![]()
ОСОБЕННОСТИ КИНЕТИКИ БС:
В БС в качестве переменных выступают не только концентрации, но и любые другие величины.
Переменные изменяются не только во времени, но и в пространстве. Скорость определяется не только константами реакции, но и диффузионными процессами.
БС пространственно неоднородны. Условия в разных частях системы могут отличаться.
БС мультистационарны. Может быть несколько устойчивых режимов функционирования.
Процессы в БС нелинейны. Феномен усиления и колебательные процессы.
Кинетические модели БС крайне сложные. Моделирование требует большого числа упрощений.
КИНЕТИЧЕСКИЕ МОДЕЛИ БС
Ряд Фибоначчи.Модель Мальтуса. Экспоненциальный рост. ![]() Модель роста популяции в избытке пит. веществ.
Модель роста популяции в избытке пит. веществ.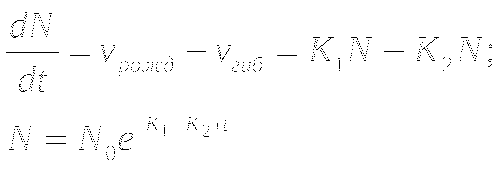
Модель Ферхюльста. Рост популяции, ограниченный ресурсами.
![]()
Модель Лотки и Вольтерра. Модель "Хищник-Жертва".
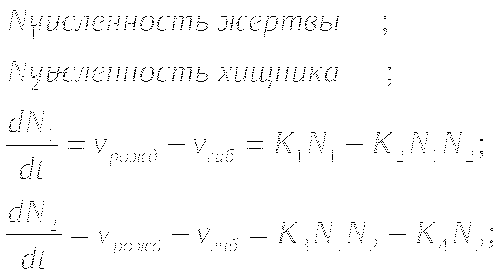
ПОНЯТИЕ СТАЦИОНАРНОГО СОСТОЯНИЯ В КИНЕТИКЕ БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
Устойчивость стационарного состояния. Критерий устойчивости. Оценка устойчивости системы, описываемой одним дифференциальным уравнением.
СС - это состояние системы в котором переменные не изменяются. Устойчивость СС характеризуется поведением системы при отклонении от СС.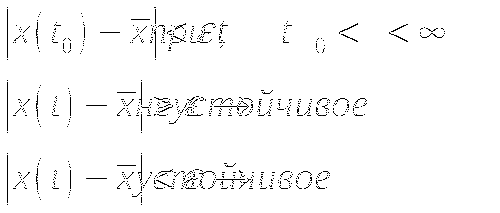
Нахождение критерия устойчивости для системы с одним дифференциальным уравнением.
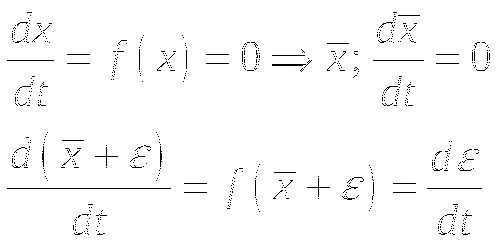
Раскладываем функцию в ряд Тейлора:
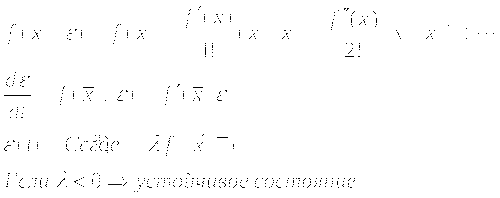
КИНЕТИЧЕСКИЕ МОДЕЛИ, ОПИСЫВАЕМЫЕ ДВУМЯ ДИФФЕРЕНЦИАЛЬНЫМИ УРАВНЕНИЯМИ
Фазовая плоскость, фазовые траектории, изоклины, особые точки. Оценка устойчивости системы. Типы особых точек и их характеристика.
В общем виде, система описывается так:
![]()
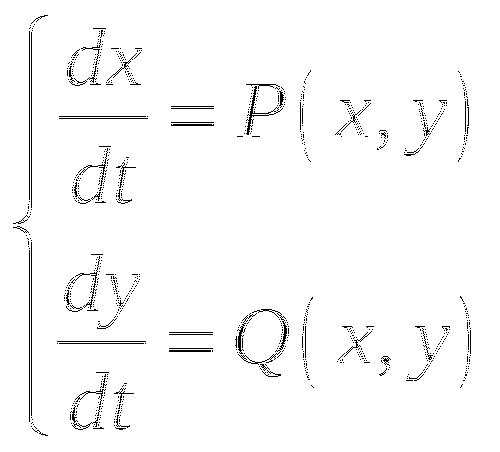
Фазовая траектория - это траектория движения изображающей точки в фазовой плоскости (x:y) во времени.
Изоклины - это линии в фазовой плоскости, во всех точках которых направления касательных к интегральным кривым будут одинаковы.
Анализ устойчивости стационарного состояния:
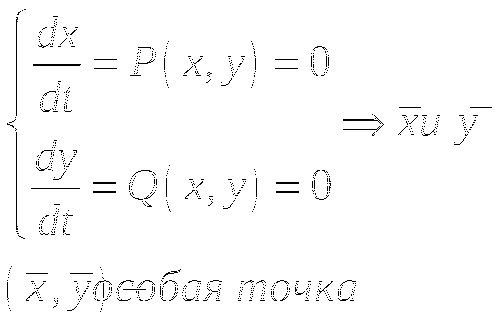
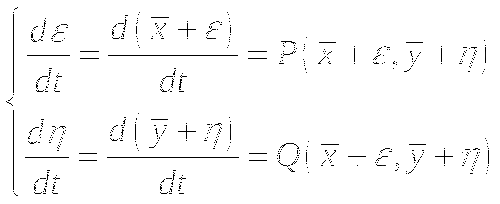
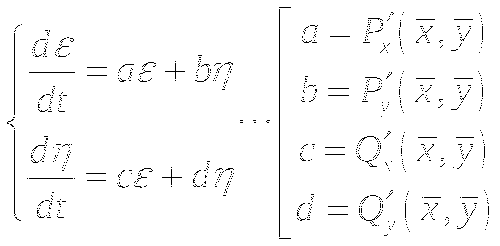
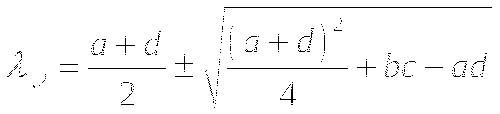
Типы особых точек:
λ1 и λ2 - действительные числа.
Одинаковый знак <0 - устойчивый узел
Одинаковый знак >0 - неустойчивый узел
Разный знак - неустойчивая особая точка типа "седло"
λ1 и λ2 - комплексно сопряжённые числа. (Re±Im)
Re<0 - Устойчивый фокус
Re>0 - Неустойчивый фокус
Re=0 - Особая точка "центр"
ХИМИЧЕСКАЯ РЕАКЦИЯ С ОБРАТНОЙ СВЯЗЬЮ
Построение простейшей математической модели. Определение координат особых точек, их типа и степени устойчивости.
![]()
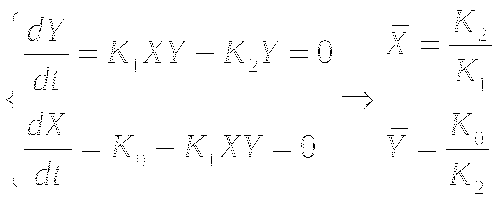
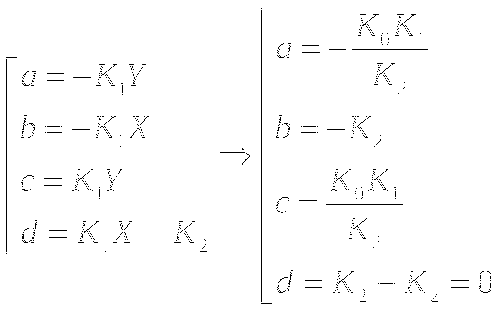
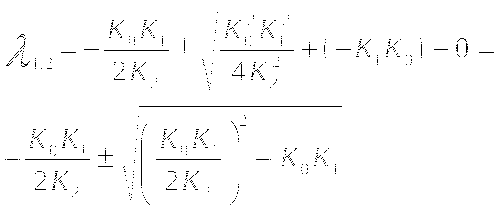
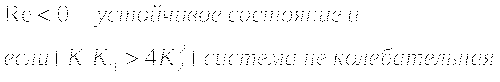
МОДЕЛЬ "ХИЩНИК - ЖЕРТВА"
Определение координат особых точек, их типа и степени
устойчивости.
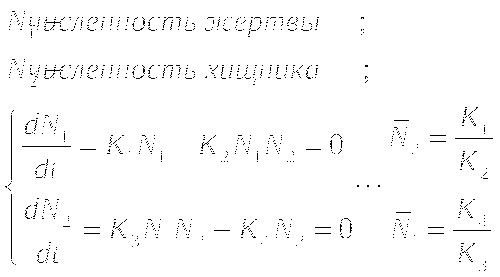
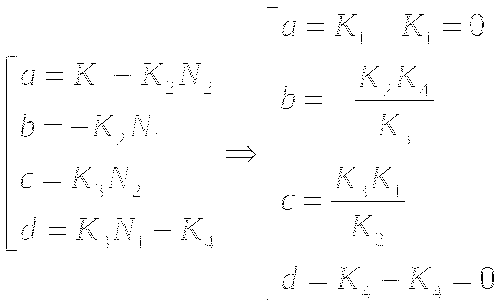
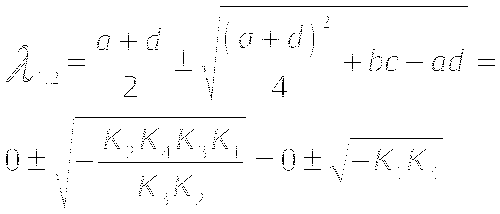
Решения являются комплексно сопряжёнными числами, Re=0, особая точка типа "центр", периодические колебания переменных системы.
МУЛЬТИСТАЦИОНАРНОСТЬ
Понятие о биологических триггерах. Способы переключения в триггерных системах. Понятие о бифуркациях.
Мультистационарные системы - это системы, имеющие несколько стационарных состояний.
В фазовом портрете системы могут существовать множества точек, к которым притягивается или от которых отталкивается изображающая точка при t→∞ или t→-∞. Такие множества называются предельные множества.
Предельные множества подразделяются на Аттракторы и Репеллеры. Предельное множество в виде замкнутой кривой - предельный цикл.
Триггерные системы - это мультистационарные системы, способные переходить из одного стационарного состояния в другое.
Переключение в триггерных системах может происходить двумя способами:
Силовой, специфический.
Переход системы из области действия одного аттрактора в область действия другого за счёт действия внешних сил на переменные системы.
Параметрический, неспецифический.
Параметры системы изменяются таким образом, что в фазовом портрете системы остаётся только одна особая точка, в которую эта система и переходит.
Процесс изменения фазового портрета системы, количества предельных множеств и их устойчивости - бифуркация. Значения параметров системы, при которых она меняет своё поведение называют критическими точками или точками бифуркации.
Мягкие бифуркации.
Кризисы и катастрофы.
Бифуркация, приводящая к появлению предельного цикла - Бифуркация Андронова-Хопфа.
АВТОКОЛЕБАТЕЛЬНЫЕ ПРОЦЕССЫ В БИОЛОГИЧЕСКИХ СИСТЕМАХ. ИХ СВОЙСТВА И УСЛОВИЯ ВОЗНИКНОВЕНИЯ
Автоколебательные процессы устанавливаются за счёт явлений внутри системы.
Амплитуда автоколебаний зависит только от свойств самой системы.
АК процессы возможны только вдали от ТД равновесия.
Причиной АК процессов является наличие большого числа взаимодействующих элементов и обратных связей между ними.
АК процессы всегда устойчивы, отклонения всегда затухают.
В фазовом портрете системы АК процессу соответствует предельное множество - предельный цикл.
Предельный цикл - это изолированная замкнутая кривая на фазовой плоскости, к которой стремятся все интегральные кривые. В этом случае система функционирует в стационарном режиме с определённой амплитудой. Бифуркация, приводящая к появлению предельного цикла - Бифуркация Андронова-Хопфа.
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Принципиальная схема ферментативной реакции. Математическое моделирование ферментативной реакции. Уравнение Михаэлиса-Ментен. Ингибирование ферментативных процессов.
Общая схема ферментативной реакции:
![]()
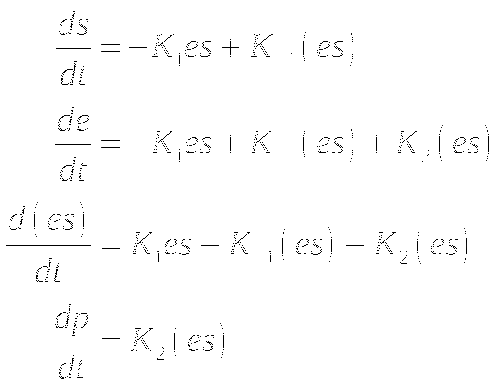
Так как p+s=const и e+(es)=e0
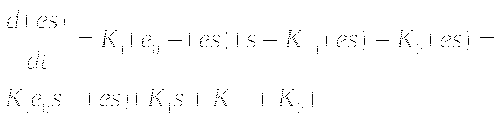
При избытке субстрата система быстро достигает стационарного состояния при котором (es)=const. При этом d(es)=0. Методом квазистационарных состояний можно найти
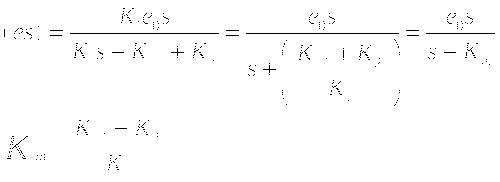
Константа Михаэлиса равна отношению суммы констант распада комплекса к константе образования комплекса. Численно равна концентрации субстрата при которой половина молекул фермента связана в фермент-субстратный комплекс. Скорость реакции максимальна, когда все молекулы фермента связаны в фермент-субстратный комплекс.
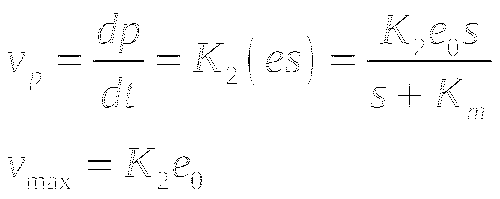
Ферментативные процессы являются регулируемыми.
Конкурентное ингибирование - сродство с активным центром.
Неконкурентное ингибирование - аллостерическое.
Антиконкурентное ингибирование - ингибитор соединяется с (es) комплексом.
Смешанное ингибирование - по активному и аллостерическому центру.
Ингибирование избытком субстрата.
ДИНАМИЧЕСКИЙ ХАОС. ЕГО ХАРАКТЕРИСТИКА
Динамический хаос и самоорганизующиеся системы. Значение динамического хаоса для самоорганизующихся систем.
Динамический хаос - явление в теории динамических систем, при котором поведение нелинейной системы выглядит случайным и является непредсказуемым на больших временах. Причиной появления хаоса является неустойчивость по отношению к начальным условиям и параметрам: малое изменение начального условия со временем приводит к сколь угодно большим изменениям динамики системы.
Тип аттрактора, соответствующий состоянию динамического хаоса - странный аттрактор.
Динамический хаос может протекать в системе в качестве перехода к самоорганизации, а может протекать в уже организованной системе. Динамический хаос представляет собой множественные бифуркации. Хаотическое поведение системы приводит к образованию фрактальных диссипативных структур.
ПЕРВЫЙ И ВТОРОЙ ЗАКОНЫ ТЕРМОДИНАМИКИ
Их формулировка и физический смысл. Обратимые и необратимые процессы.
Первый закон термодинамики выражает закон сохранения энергии в общем виде.
![]()
Изменение внутренней энергии системы может происходить за счёт обмена теплоты, за счёт работы и за счёт обмена веществом, в случае открытой системы.
Работа в общем виде представлена выражением
![]()
F - движущая сила. dx - изменение параметра.
Fdl - механическая работа
pdV - работа расширения газа
UdQ - электрическая работа
μdν - химическая работа
Второй закон термодинамики был сформулирован Клаузиусом. Невозможно построить двигатель, который работал бы по полному циклу Карно и превращал всю теплоту в работу. Теплота не может самопроизвольно переходить от холодного тела к нагретому.
В реальных тепловых двигателях
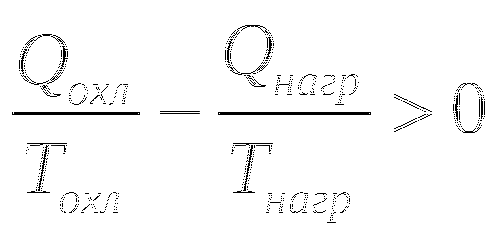
Часть теплоты подводимой от нагревателя расходуется на увеличение молекулярного движения, температуры рабочего тела. Клаузиус также ввёл понятие энтропии, как функции состояния, приращение которой равно теплоте, подведённой к системе в обратимом изотермическом процессе, делённой на абсолютную температуру, при которой происходит этот процесс.
![]()
Энтропия изолированной системы может только возрастать.
Необратимые процессы, после протекания которых систему и среду нельзя вернуть в прежнее состояние одновременно. Необратимые процессы приводят систему к состоянию ТД равновесия.
Обратимые процессы, после протекания которых и систему, и среду можно вернуть в исходное состояние.
ПОНЯТИЕ ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ
Равновесные и неравновесные системы. Критерии эволюции системы к состоянию термодинамического равновесия.
ТД равновесие - это устойчивое состояние системы, при котором интенсивные параметры одинаковы во всех частях системы. К равновесному состоянию приходит изолированная система по истечении достаточно большого промежутка времени.
Равновесная система - Интенсивные переменные в разных частях системы одинаковы. Движущие силы отсутствуют. Если такая система изолирована, то она может находиться в состоянии равновесия неограниченно долго.
Неравновесная система - Интенсивные переменные в разных частях системы различаются. Если такая система изолирована, то она необратимо эволюционирует к состоянию ТД равновесия. В ней возникают движущие силы, влекущие систему к состоянию ТД равновесия.
Критерии эволюции системы к ТД равновесию:
Максимальная энтропия. При U и V = const.
В точке ТД равновесия энтропия максимальна.
Минимальная U. При S, V =const.
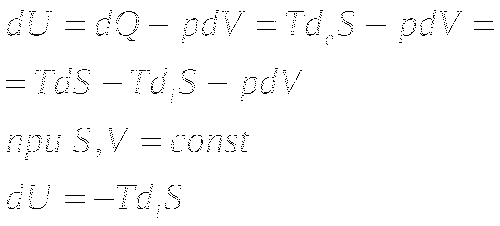
При приближении к состоянию ТД равновесия, внутренняя энергия системы уменьшается.
Минимальная свободная энергия.
Энергия Гельмгольца. T, V=const.
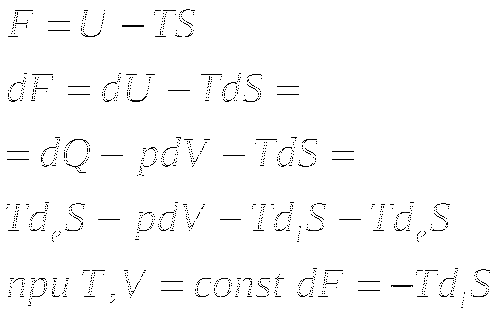
Энергия Гиббса. T, p=const.
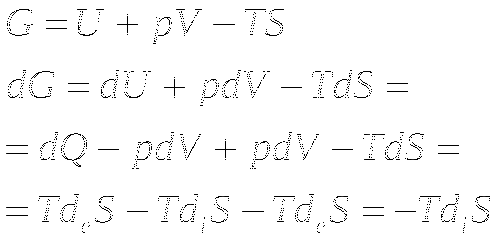
Энтальпия
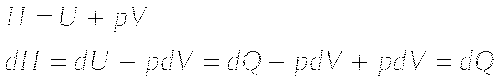
ПРИНЦИПЫ ЭКСТРЕМУМОВ В ТЕРМОДИНАМИКЕ. ИХ СУЩНОСТЬ И ЗНАЧЕНИЕ
Принцип экстремумов заключается в том, что в системах самопроизвольные процессы всегда стремятся к минимуму внутренней энергии и максимуму энтропии, поэтому можно предсказать эволюцию системы, найдя экстремальные значения переменных с минимальной внутренней энергией. Зная зависимость внутренней энергии от переменной системы можно найти значение этой переменной, соответствующее минимальной энергии, а следовательно, состоянию термодинамического равновесия или стационарному состоянию, в случае ограничений, наложенных на систему.
Критерии эволюции системы к ТД равновесию:
Максимальная энтропия. При U и V = const.
В точке ТД равновесия энтропия максимальна.
Минимальная U. При S, V =const.
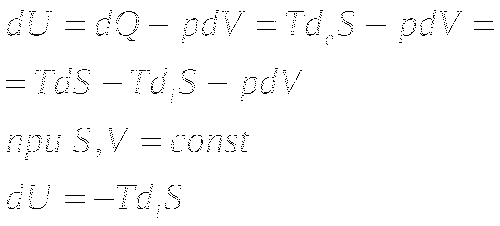
При приближении к состоянию ТД равновесия, внутренняя энергия системы уменьшается.
Минимальная свободная энергия.
Энергия Гельмгольца. T, V=const.
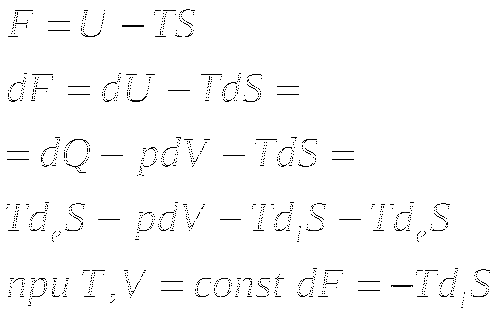
Энергия Гиббса. T, p=const.
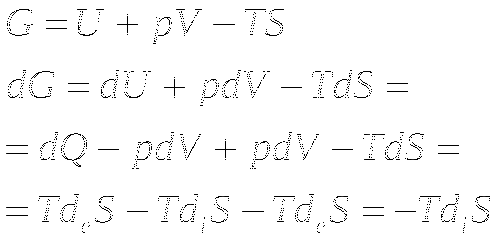
Энтальпия
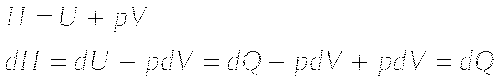
Минимальное значение свободной энергии сводится к максимальному значению энтропии.
ЭНТРОПИЯ
Её физический смысл с позиций термодинамики и молекулярной физики. Связь энтропии и информации.
Энтропия - это функция состояния системы, приращение которой равно теплоте, подведённой к системе в обратимом изотермическом процессе, делённой на абсолютную температуру при которой происходит этот процесс.
![]()
Больцман ввёл понятие энтропии, как величины, пропорциональной логарифму вероятности нахождения системы в конкретном макросостоянии.
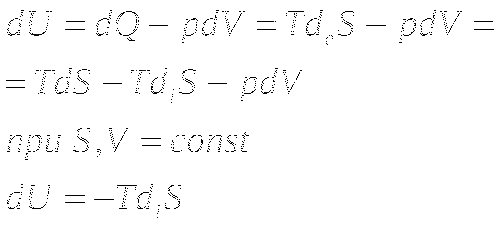
P - это то число микросостояний, которыми может быть реализовано данное макросостояние.
K - Постоянная Больцмана 1,38х10-23 Дж/К.
Необратимые процессы, ведущие систему к увеличению энтропии, ведут систему к максимальному числу микросостояний, к ТД хаосу, равновесию.
В состоянии ТД равновесия, при максимальной энтропии, информационная структура системы нулевая. Энтропия и информация связаны, как обратные величины: уменьшение энтропии системы связано с увеличением информации этой системы.
ИЗМЕНЕНИЕ ЭНТРОПИИ В ОТКРЫТЫХ СИСТЕМАХ
Определение скорости продукции энтропии в открытых системах.
В открытых системах скорость продуцирования энтропии складывается из скорости продуцирования энтропии за счёт внутренних необратимых процессов и за счёт обмена энтропией с внешней средой.
![]()
Изменение внутренней энергии в открытой системе складывается из изменения теплоты, работы и обмена веществом с внешней средой.
![]()
![]()
Приведя выражение к изменению энтропии, получаем:
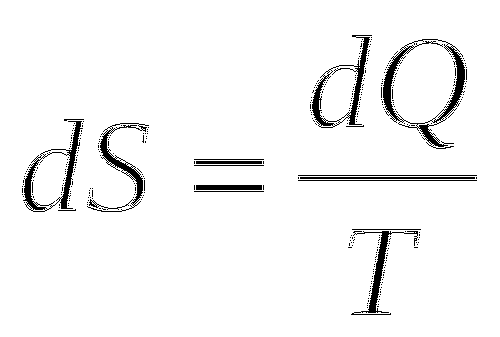
Изменение энтропии складывается из обмена с внешней средой энергией, работой и веществом.
В самопроизвольной химической реакции изменение энтропии за счёт внутренних необратимых процессов связано только с изменением количества реагирующих веществ.
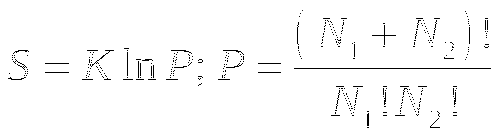
Для химической реакции x+y=2z
![]()
![]() -степень полноты реакции.
-степень полноты реакции.
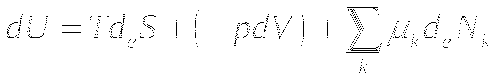
A - химическое сродство. Является движущей силой химической реакции. Реакция идёт до тех пор, пока A>0.
Таким образом, в открытых системах общее изменение энтропии равно:
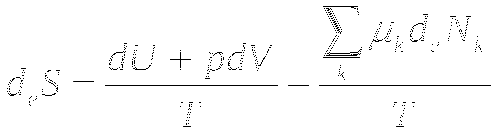
ПОНЯТИЕ ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ. ОБЩИЕ СВОЙСТВА СИСТЕМ ВБЛИЗИ
ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ
Интенсивные переменные в разных точках системы различаются не резко.
ТД силы и скорости процессов невелики, скорости линейно зависят от движущих сил. Выполняется соотношение Онзагера.
Скорость продуцирования энтропии пропорциональна произведению скоростей процессов на движущие силы.
Все стационарные состояния являются устойчивыми.
Аттракторами могут являться ТД равновесие и любое стационарное состояние.
Флуктуации, приводящие к отклонению от аттракторов, затухают.
Вблизи ТД равновесия невозможна временная и пространственная упорядоченность.
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА СТАЦИОНАРНОГО СОСТОЯНИЯ И ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ. КРИТЕРИИ ЭВОЛЮЦИИ СИСТЕМЫ К СТАЦИОНАРНОМУ СОСТОЯНИЮ. ТЕОРЕМА ПРИГОЖИНА.
В стационарном состоянии свободная энергия и работоспособность системы постоянны, а в состоянии ТД равновесия они минимальны.
В СС энтропия постоянна, а в ТД равновесии она максимальна.
В СС существуют градиенты переменных и могут протекать ТД процессы, а в состоянии ТД равновесия градиенты и процессы отсутствуют.
Если на систему наложены ограничения, препятствующие её переходу в состояние ТД равновесия, она переходит в СС.
т. Пригожина
Пусть в системе имеется два потока: J1≠0 и J2=0, тогда диссипативная функция:
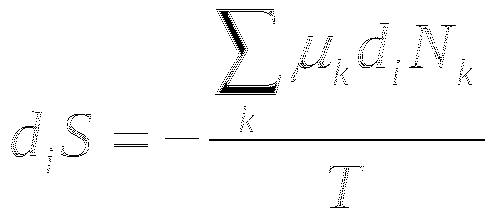
Будем считать фиксированной силу X1=const.
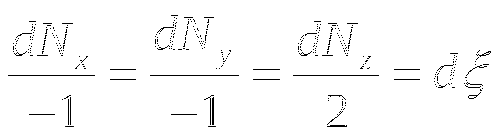
Если система близка к состоянию ТД равновесия, выполняется соотношение Онзагера L12=L21 и
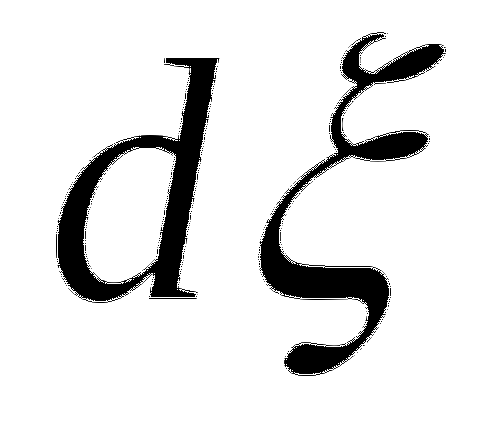
В стационарном состоянии, близком к равновесию, продукция энтропии минимальна. Теорема Пригожина представляет собой критерий эволюции системы к стационарному состоянию и показывает, что вблизи ТД равновесия невозможны колебательные процессы.
ТЕРМОДИНАМИЧЕСКИЙ ПОДХОД К АНАЛИЗУ СОПРЯЖЁННЫХ ПРОЦЕССОВ
Связь между потоками, движущими силами и скоростью продуцирования энтропии при сопряжении. Соотношение Онзагера. Биологические примеры сопряжённых процессов.
В околоравновесных системах скорость продуцирования энтропии пропорциональна движущим силам.
![]()
В сопряжённых процессах потоки зависят от обобщённых движущих сил.
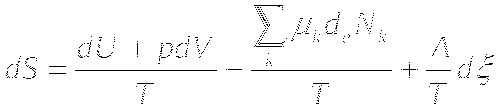
Процесс i сопряжён с процессами j.
Рассмотрим два сопряжённых процесса:
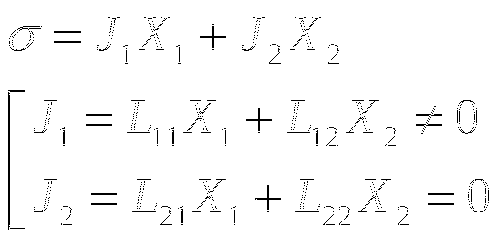
Диссипативная функция для сопряжённых процессов:
![]()
Вблизи равновесия по соотношению Онзагера:
![]()
В условиях сопряжения, диссипативная функция отдельных потоков может быть отрицательной, но при этом, диссипативная функция всей системы будет больше нуля. Если один поток отрицателен, то диссипативная функция сопряжённых потоков должна выполнять условие:
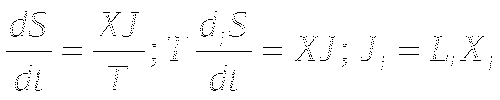
Таким образом, сопряжение процессов позволяет прохождению в системе процессов, невозможных в замкнутой системе.
Наиболее типичными сопряжениями процессов в БС являются процессы сопряжения гидролиза АТФ с эндэргоническими процессами, что позволяет этим процессам протекать. Без сопряжения эти процессы были бы невозможны.
СКОРОСТЬ ПРОДУЦИРОВАНИЯ ЭНТРОПИИ ВБЛИЗИ СТАЦИОНАРНОГО СОСТОЯНИЯ СИСТЕМЫ. ТЕОРЕМА ПРИГОЖИНА
При неизменных внешних условиях в СС, близком к ТД равновесию, скорость прироста энтропии за счёт внутренних необратимых процессов достигает отличного от нуля минимального положительного значения.
т. Пригожина
Пусть в системе имеется два потока: J1≠0 и J2=0, тогда диссипативная функция:
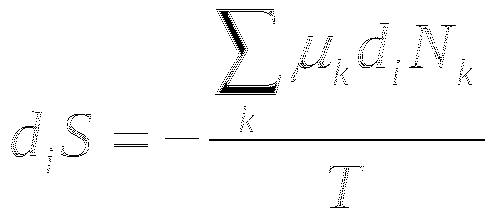
Будем считать фиксированной силу X1=const.
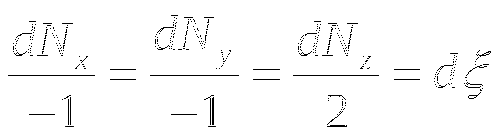
Если система близка к состоянию ТД равновесия, выполняется соотношение Онзагера L12=L21 и
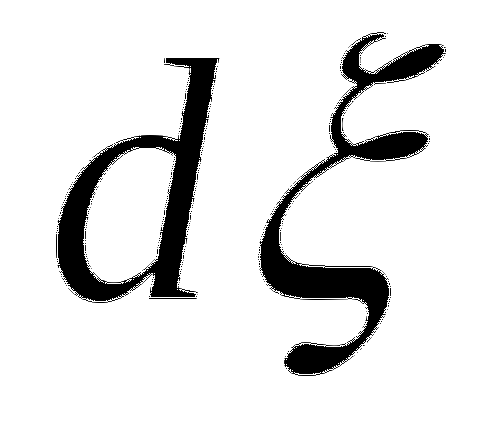
В стационарном состоянии, близком к равновесию, продукция энтропии минимальна. Теорема Пригожина представляет собой критерий эволюции системы к стационарному состоянию и показывает, что вблизи ТД равновесия невозможны колебательные процессы.
ОБЩИЕ СВОЙСТВА СИСТЕМ ВДАЛИ ОТ ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ
Интенсивные переменные в разных точках системы резко отличаются, поэтому движущие силы и скорости процессов достаточно велики.
Скорости процессов не являются линейными функциями движущих сил, соотношение Онзагера не выполняется.
Скорость продуцирования энтропии не пропорциональна произведению скоростей процессов на движущие силы. По изменениям диссипативной функции нельзя однозначно судить о приближении системы к СС. Теорема Пригожина не выполняется.
Вдали от ТД равновесия возможны неустойчивые СС.
Большую роль в работе системы играют флуктуации.
Эволюция системы может приводить к возникновению упорядоченных структур. Диссипативные структуры.
Флуктуации - это случайные отклонения переменных от их стационарных значений.
Если СС устойчиво, то Ф. не могут вывести систему из этого СС. Если СС неустойчиво, то Ф. приводят к значительным отклонениям системы от СС до перехода этой системы в новое СС. Ф. играют большую роль во временной эволюции системы, особенно вблизи точек бифуркации.
ДИССИПАТИВНЫЕ СТРУКТУРЫ: ИХ КЛАССИФИКАЦИЯ
Условия возникновения диссипативных структур. Характеристика отдельных видов диссипативных структур.
Химические ДС. Возникают в химических неравновесных системах.
Реакции Белоусова-Жоботинского. Характерна временная упорядоченность, возникновение автоколебательных процессов. Это связано с наличием большого числа взаимодействующих веществ, автокаталитических стадий и обратных связей. В случае достаточного объёма системы и при наличии диффузионных процессов образуется пространственная упорядоченность, структуры Тьюринга.
Физические ДС.
Неустойчивость Бенара. Образовании гексагональных ячеек в жидкости высокой плотности при наличии градиента температуры и конвекционных потоков. Также к физическим ДС относятся гидродинамические турбулентности, которые также являются неравновесными системами.
Биологические ДС.
Все биологические системы являются резко неравновесными и упорядоченными в пространстве и времени. В биологических системах наиболее часто встречаются диссипативные структуры.
Образование пространственных структур в жизненном цикле слизевика: На начальной стадии, при достатке пищи, существуют отдельные миксамёбы. При недостатке питательных веществ отдельные миксамёбы начинают выделять в среду цАМФ, который распространяется в среде посредством диффузии. цАМФ воспринимается другими миксамёбами, и оказывает на них двойной эффект: он вызывает вторичное выделение этими миксамёбами цАМФ, что приводит к усилению сигнала, а также вызывает движение миксамёб по градиенту концентрации в направлении к источнику первичного сигнала. При этом формируется пространственно упорядоченная диссипативная структура - плазмодий.
Чтобы общее изменение энтропии было отрицательным, изменение энтропии за счёт обмена с внешней средой должно быть по модулю больше, чем изменение за счёт внутренних необратимых процессов, и отрицательно. Должен происходить экспорт энтропии во внешнюю среду и поступление свободной энергии в систему.
Экспорт энтропии, превышающий её производство в системе происходит с участием энтропийных насосов. По характеру энтропийных насосов самоорганизующиеся системы делятся на:
Пассивные. Когда энтропийный насос находится в окружающей среде и закачивает свободную энергию в систему. Пример: Ячейки Бернара.
Активные. Энтропийный насос является частью самой системы. Такая система способна активно, самостоятельно поглощать свободную энергию из окружающей среды. К активным относятся все живые системы.
ИНФОРМАЦИЯ В БИОЛОГИИ
Информация - это величина, понижающая энтропию системы, приводящая к её упорядоченности.
Получение системой И. приводит к снятию неопределённости и возрастанию порядка в системе.
Приём и передача И. связаны с необратимым производством энтропии в системе.
В состоянии ТД равновесия И. системы равна нулю, а энтропия максимальна.
Источником и приёмником И. могут быть только высокоупорядоченные открытые системs/ Такими системами являются, например, все живые системы.
И. существует в сигнально-кодовой форме.
И. инвариантна относительно формы её представления.
Для оперирования И. существуют специализированные информационные структуры: генетическая, гуморальная, нервная и многочисленные экстрасоматические системы.
Для того чтобы система могла использовать информацию должны выполняться некоторые условия:
Система должна быть мультистационарной.
Система должна быть устойчивой. Переключение триггерной системы должно происходить только под действием внешних сил. Это обеспечивает существование феномена памяти. Обусловленные флуктуациями переходы должны происходить крайне редко.
В фазовом пространстве системы должна существовать область, из которой доступны все аттракторы данной системы. Направление перехода должно зависеть только от типа внешнего воздействия.
ФЕНОМЕН БЕЛКА В БИОФИЗИКЕ. УНИКАЛЬНОСТЬ СТРОЕНИЯ И СВОЙСТВ БЕЛКА
Белки являются биополимерами, состоящими из аминокислотных остатков, соединённых пептидными связями. Они часто имеют нерегулярное строение и сложную пространственную структуру.
Белки способны к взаимному превращению практически любых форм энергии и к использованию энергии для совершения работы. Белки таким образом определяют функциональную активность живых систем.
Белки крайне вариабельны и уникальны. Белки многообразны по своей структуре и выполняемым функциям. В то же время белки, выполняющие одинаковую функцию могут иметь различную структуру, и наоборот.
Белки выполняют свои функции в физиологических, мягких условиях. При их функционировании редко образуются побочные продукты.
Белки образуют сложную пространственную структуру. Она образуется в результате самоорганизации на основе первичной структуры и полностью определяется ею.
Пространственная организация имеет принципиальное значение для реализации свойств белка.
ЭЛЕМЕНТАРНЫЕ ВЗАИМОДЕЙСТВИЯ В БЕЛКАХ
Их виды. Ковалентные, координационные связи и силы Ван-дер-Ваальса. Их характеристика.
Элементарные взаимодействия в белках делятся на: Ковалентные связи, Координационные связи, Силы Ван-дер-Ваальса, Водородные связи и Гидрофобные взаимодействия.
Ковалентные связи.
В белках наибольшую роль играют пептидные связи - между соседними АК, и дисульфидные связи - между удалёнными серосодержащими АК одной или разных цепей. Цистеин.
Координационные связи.
Образуются между атомами O, N или S с 2х или 3х валентными ионами металлов, обычно входящих в активный центр белка. При этом образуется хелатное соединение металла с несколькими атомами белка.
Взаимодействия Ван-дер-Ваальса.
Возникают при сближении атомов с полностью заполненными орбиталями. Эти взаимодействия имеют квантовую природу и обусловлены синхронизацией колебаний электронов взаимодействующих атомов.
Взаимодействие проявляется притягиванием на больших расстояниях и отталкиванием на малых расстояниях, при этом атомы располагаются на стабильном расстоянии друг от друга и не могут приближаться друг к другу ближе, чем на 3Ǻ.
Силы Ван-дер-Ваальса также обеспечивают запрет цис-конформации пептидной связи и устойчивость транс-конформации.
ЭЛЕМЕНТАРНЫЕ ВЗАИМОДЕЙСТВИЯ В БЕЛКАХ. ВОДОРОДНЫЕ СВЯЗИ И ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ. ИХ ХАРАКТЕРИСТИКА
Элементарные взаимодействия в белках делятся на: Ковалентные связи, Координационные связи, Силы Ван-дер-Ваальса, Водородные связи и Гидрофобные взаимодействия.
Водородные связи.
Образуются между атомом водорода, ковалентно связанным с электроотрицательным атомом и другим электроотрицательным атомом. Водородная связь имеет электростатическую природу и связана с наличием парциальных зарядов на взаимодействующих атомах. Водородная связь направлена от донора(водород) к акцептору(атому O или N). Водород всегда выступает донором одной водородной связи, кислород может быть акцептором двух водородных связей.
В белках водородные связи образуются между отдельными группами аминокислотных остатков и между полярными АК и молекулами воды.
Гидрофобные взаимодействия.
Возникают между гидрофобными участками АК цепи. Неполярный участок препятствует образованию водородных связей между молекулами воды. Это приводит к уменьшению энтропии в системе и увеличению свободной энергии, так как происходит уменьшение числа степеней свободы у молекул воды, находящихся в контакте с неполярным участком. Далее происходит самопроизвольный процесс сближения гидрофобных участков для уменьшения поверхности их соприкосновения с молекулами воды. Таким образом, гидрофобные взаимодействия обусловлены эволюцией белка к стационарному состоянию с минимальной площадью контакта гидрофобной части с молекулами воды. В белках наиболее гидрофобные остатки образуют "гидрофобное ядро", окружённое гидрофильными остатками.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА. ПЕПТИДНАЯ СВЯЗЬ И ЕЁ СВОЙСТВА
Пространственная конфигурация полипептидной цепи. Факторы её определяющие. Карты Рамачандрана.
Первичная структура полипептидной цепи представлена последовательностью АК остатков, соединённых пептидными связями. Возможные конфигурации пептидной цепи прежде всего обусловлены плоским строением пептидной связи.
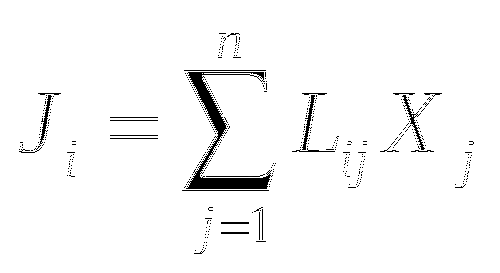
Валентные углы. Порядка 109°.
Двугранные углы поворота вокруг валентной связи
ω - Угол внутри пептидной связи, наиболее стабилен и составляет около 179°.
φ и ψ углы - Между Cα атомом и C или N пептидной связи.
χ - Между Сα атомом и атомом боковой цепи.
В то время как валентные углы и ω угол достаточно постоянны, углы φ и ψ сильно отличаются и зависят от АК остатков, связанных пептидной связью, а также от прочих условий.
Для определения наиболее устойчивых значений этих углов и запрещённых конформаций были получены стерические карты Рамачандрана для разных АК. Расчёт карт Рамачандрана проводился из предположения об атомах, как твёрдых сферах с Ван-дер-ваальсовыми радиусами. Область разрешённых значений углов зависит в большой степени от размера радикала и от соседних АК, также свои ограничения накладывают и другие типы взаимодействий в белке.
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
Типы вторичной структуры, их особенности. Образование вторичной структуры белка.
α-структура.
Стабилизирована водородными связями между H пептидной группы и карбонильным O отстоящим на 4 АК остатка. В образовании спирали участвуют все пептидные группы. Так как задействуются все водородные связи, спираль приобретает гидрофобные свойства. Вся спираль представляет собой диполь, "+" на N-конце и "-" на C-конце. α-спираль является самой устойчивой вторичной структурой и самой часто встречающейся. Некоторые АК могут нарушать структуру спирали, препятствуя её сворачиванию, это АК с крупными радикалами: пролин, гистидин, триптофан.
β-структура.
В β-структуре водородные связи образуются между параллельно уложенными цепями, при этом образуются слои или листы. Бывают параллельные, антипараллельные и смешанные β-слои. При этом β-слои всегда имеют некоторую скрученность и также являются гидрофобными структурами за счёт полностью задействованных водородных связей.
Спирали без водородных связей.
Такие спирали образуются только за счёт сил Ван-дер-Ваальса. Например, полипролиновая спираль в молекуле коллагена.
Нерегулярная структура.
Часто встречается нерегулярная пространственная структура с чередованием регулярных и нерегулярных участков. Такая структура характерна для большинства функциональных белков.
Образование α-спирали происходит как нефазовый переход, так как оба фазовых состояния одномерны и не происходит изменения границы фаз.
Образование β-листов происходит как ФП 1 рода, площадь контакта цепи с листом зависит от размера контактирующих элементов. Процесс образования β-структуры происходит значительно дольше.
ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА. КЛАССИФИКАЦИЯ БЕЛКОВ ПО ТИПУ ТРЕТИЧНОЙ СТРУКТУРЫ
Третичная структура белков стабилизируется гидрофобными взаимодействиями, водородными и дисульфидными связями.
Различают третичную структуру у фибриллярных, глобулярных и мембранных белков.
Наиболее простая третичная структура характерна для фибриллярных белков. Для них характерна высокая регулярность первичной и вторичной структуры и большие размеры полипептидной цепи.
α-структурные. Например, коллаген.
Первичная структура представлена полимером трипептида (-гли-про-про-), закрученного во вторичную структуру α-спираль. Третичная структура представлена суперспиралью из трёх полипептидных цепей.
β-структурные. Например, фиброин шёлка.
Фиброин образован чередующимися АК глицина и аланина, уложенными в β-слои по 8 блоков. Эти структуры затем накладываются друг на друга, образуя более сложную структуру.
Существуют также глобулярные белки, образующие фибриллярную третичную структуру. К таким белкам относится актин.
Глобулярные белки имеют наиболее сложную пространственную структуру. В центральной части глобулы обычно располагается гидрофобное ядро, образованное α и β-структурами и гидрофобными АК. На периферии располагаются нерегулярные петли, гидрофильные участки, образующие водородные связи с молекулами воды. В глобулярных белках часто выделяют промежуточную доменную структуру, образованную стабильными сочетаниями блоков вторичной структуры. По преобладающим типам структуры выделяют: α-глобулы, β-глобулы и смешанные белки.
К отдельному типу относят мембранные белки. Их особенностью является наличие трансмембранного участка, образованного гидрофобными структурами и обращённого к липидам мембраны. Для трансмембранного участка обычно характерна высокая регулярность укладки и простота третичной структуры. Гидрофильные участки располагающиеся на поверхности мембраны имеют нерегулярную структуру.
ОБРАЗОВАНИЕ И РАЗРУШЕНИЕ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКА С ПОЗИЦИИ ТЕОРИИ ФАЗОВЫХ ПЕРЕХОДОВ
Фаза вещества - это состояние вещества, которому в данных условиях соответствует минимум свободной энергии. При изменении условий могут происходить переходы между фазами, изменение фазового состояния вещества. По характеру изменения свободной энергии выделяют три типа фазовых переходов.
ФП 1 рода.
В процессе ФП наблюдается только начальное и конечное состояния, невозможно уловить промежуточные состояния. ФП происходит в узком диапазоне условий, зависимость свободной энергии от условий носит S-образный характер. Изменение фазы происходит по принципу "Всё или Ничего". Стабильные состояния между ФП 1 рода разделены достаточно высоким энергетическим барьером, поэтому они происходят достаточно длительное время.
ФП 2 рода.
Для этого типа ФП характерно постепенное изменение фазы через многочисленные промежуточные состояния, принцип "Всё или Ничего" отсутствует. Скачок энергии в малом диапазоне условий отсутствует, поэтому ФП 2 рода происходят быстро и в более широком диапазоне условий. При достижении температуры ФП происходит скачок теплоёмкости системы, в результате дальнейший рост температуры сопровождается слабым ростом энергии.
Нефазовые переходы.
Для них характерно значительное изменение упорядоченности системы без изменения её агрегатного состояния и размерности.
В процессах денатурации и ренатурации белка разные стадии представляют собой фазовые переходы разного рода. Для малых белков процесс можно считать одностадийным. Этот процесс происходит как ФП 1 рода.
![]()
Для крупных белков этот процесс многостадийный, и разные его стадии происходят как ФП разного рода.
![]()
Ранние этапы самосборки различаются в зависимости от типа вторичной структуры.
Образование α-спирали происходит как нефазовый переход, так как оба фазовых состояния одномерны и не происходит изменения границы фаз.
Образование β-листов происходит как ФП 1 рода, площадь контакта цепи с листом зависит от размера контактирующих элементов. Процесс образования β-структуры происходит значительно дольше.
Процесс образования и разрушения нативной структуры происходит как ФП 1 рода. В процессе этого перехода происходит изменение энтропии системы, компенсированное изменением свободной энергии. Это обеспечивается наличием большого числа слабых связей с низкой энергией.
К ФП 2 рода могут относиться процессы образования и разрушения доменных структур, которые часто сопровождаются ростом теплоёмкости системы.
ДЕНАТУРАЦИЯ БЕЛКА. ЕЁ ТЕРМОДИНАМИЧЕСКАЯ ХАРАКТЕРИСТИКА
Этапы денатурации белка. Механизмы денатурации. Способы денатурации.
Денатурация - это процесс разрушения нативной пространственной структуры белка. Этот процесс сопровождается изменением функциональной активности, упорядоченности боковых групп и фиксированности глобулярной структуры. В термодинамическом плане денатурация сопровождается увеличением энтропии и уменьшением свободной энергии белка. Существует два механизма денатурации для малых и крупных белковых молекул.
1.![]()
2.![]()
В первом случае процесс денатурации представляет собой ФП 1 рода, что обеспечивается наличием большого числа слабых связей с глобуле.
Во втором случае на первом этапе плавления глобулы происходит нарушение упорядоченности боковых групп, но сохраняется общая пространственная структура. Этот переход происходит как ФП 1 рода. Дальнейшие этапы денатурации зависят от доменной и вторичной структуры и могут происходить как ФП любого рода.
Расплавленная глобула является устойчивым интермедиатом разворачивания белка и характеризуется минимумом свободной энергии.
По способам денатурации различается
Температурная.
Существует тепловая и холодовая денатурация. При тепловой происходит разрушение связей за счёт увеличения скорости теплового движения, а при Холодовой происходит ослабление гидрофобных взаимодействий, что приводит к падению стабильности белка.
Химическая.
Связана с оттягиванием части водородных связей химическими веществами, часто электролитами, что приводит к падению устойчивости боковых групп. (мочевина, гуанидин гидрохлорид)
Лучевая.
Лучевая денатурация связана с поглощением атомами энергии, приводящим к разрыву ковалентных связей.
САМООРГАНИЗАЦИЯ БЕЛКА. ЭТАПЫ САМООРГАНИЗАЦИИ БЕЛКА
Термодинамическая оценка процесса самоорганизации. Особенности процесса самоорганизации белка в условиях in vivo. Парадокс левинталя, его сущность и разрешение.
Самоорганизация - это путь к глобальному минимуму свободной энергии. Этот путь единственно возможный в данных условиях для данной молекулы. Для белков процесс самоорганизации заключается в образовании пространственной структуры.
В процессе ренатурации белка разные стадии представляют собой фазовые переходы разного рода. Для малых белков процесс можно считать одностадийным. Этот процесс происходит как ФП 1 рода.
![]()
Для крупных белков этот процесс многостадийный, и разные его стадии происходят как ФП разного рода.
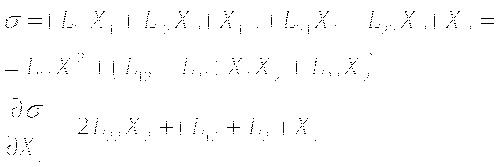
Ранние этапы самосборки различаются в зависимости от типа вторичной структуры.
Образование α-спирали происходит как нефазовый переход, так как оба фазовых состояния одномерны и не происходит изменения границы фаз.
Образование β-листов происходит как ФП 1 рода, площадь контакта цепи с листом зависит от размера контактирующих элементов. Процесс образования β-структуры происходит значительно дольше.
Процесс образования нативной структуры из расплавленной глобулы происходит как ФП 1 рода. В процессе этого перехода происходит уменьшение энтропии системы, компенсированное падением свободной энергии. Это обеспечивается наличием большого числа слабых связей с низкой энергией.
К ФП 2 рода могут относиться процессы образования и разрушения доменных структур, которые часто сопровождаются ростом теплоёмкости системы.
Парадокс Левинталя заключается в том, что каждый АК остаток имеет порядка 10 возможных конформаций, цепь из 100 АК остатков будет иметь 10100 возможных конформаций. При этом, белок должен менять свою конформацию в сторону наименьшей свободной энергии и "почувствовать" стабильное состояние. При этом перебор возможных состояний даже короткой цепи в 100 АК потребовал бы 1080 лет при скорости перехода между конформациями порядка 10-13 секунд. Но при этом процесс образования нативной структуры происходит за время порядка 1 секунды.
Парадокс разрешается при учёте нуклеационного механизма сворачивания. Пространственная организация начинается в самом начале синтеза полипептидной цепи с образования ядра сворачивания. Ядро сворачивания образуется изначально из АК имеющих небольшое число разрешённых конформаций. В процессе синтеза цепи новые АК контактируют с ядром сворачивания, которое ограничивает число разрешённых конформаций. В процессе синтеза всё новые АК вовлекаются в ядро сворачивания, увеличивая его поверхность, скорость падения энергии системы возрастает. В этом заключается котрансляционный механизм сворачивания. Образование зародыша сворачивания соответствует локальному энергетическому минимуму, а далее система стремится к глобальному энергетическому минимуму - к нативной структуре.
Также в клетке могут присутствовать ферменты, катализирующие отдельные этапы самосборки - фолдазы, а также шаперолы, белки теплового шока, способные стабилизировать структуру синтезируемого белка, формируя с ним нековалентные связи.
МЕХАНИЗМЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА НА ПРИМЕРЕ РАБОТЫ СЕРИНОВЫХ ПРОТЕАЗ
В общем виде механизм ферментативного катализа представлен несколькими стадиями:
![]()
Сериновые протеазы катализируют процесс расщепления пептидной связи. Без участия фермента реакция идёт через промежуточное состояние тетраэдрического комплекса. Это состояние характеризуется высоким уровнем свободной энергии и для протекания реакции в отсутствии фермента необходимо преодоление высокого энергетического барьера.
Сериновые протеазы стабилизируют переходное состояние и таким образом снижают энергетический барьер.
Активный центр состоит из каталитического центра, непосредственно осуществляющего химическую трансформацию и из субстрат-связывающего центра, обеспечивающего правильное расположение субстрата в пространстве относительно каталитического центра.
Главным каталитическим центром является боковая цепь серина(195), от которой отщепляется протон, расположенным рядом остатком гистидина, при участии аспартата. Углеродный атом пептидной связи образует временную ковалентную связь с активным центром, переходя в тетраэдрическую форму. Но образующийся тетраэдрический комплекс имеет меньшую свободную энергию, так как "-" заряд карбоксильной группы втягивается в оксианионовую дыру(протоны, образующие водородные связи), а донором протона является гистидин, удобно расположенный в пространстве, благодаря неспецифической пептид-связывающей площадке, ориентирующей пептидную связь относительно активного центра. Всё это снижает неопределённость системы, уменьшает энтропию и свободную энергию системы.
В общем случае эффект действия ферментов обеспечивается эффектами:
сближения фермента и субстрата, что эквивалентно увеличению их концентрации.
ориентации участников реакции в пространстве друг относительно друга.
стабилизации промежуточного продукта реакции.
поляризации и перераспределения электронной плотности субстрата.
индуцированного соответствия фермента и субстрата.
КОНФОРМАЦИОННЫЕ ИЗМЕНЕНИЯ В БЕЛКЕ. ИХ ЗНАЧЕНИЕ ДЛЯ РАБОТЫ БЕЛКА
Конформационные изменения играют большую роль в функционировании белка. Это определяется, во-первых, индуцированным соответствием пространственной структуры: Изначально фермент находится в открытом состоянии, способном присоединять субстрат, соединение с субстратом вызывает конформационные изменения фермента и субстрата. Фермент переходит в закрытую форму. В закрытой форме фермент осуществляет катализ и под действием продуктов снова меняет конформацию на открытую и отщепляет продукты реакции.
Во-вторых, конформационные изменения могут играть роль для выполнения собственно рабочего действия белка или для перехода от одного режима действия к другому.
Примеры: K/Na-АТФаза, Воротный механизм ионных каналов, аллостерическая регуляция ферментов.
ВНУТРИМОЛЕКУЛЯРНАЯ ДИНАМИКА БЕЛКА. ИЗМЕНЕНИЯ КОНФОРМАЦИИ ГЕМОГЛОБИНА ПРИ ОКСИГЕНАЦИИ. РОЛЬ АЛЛОСТЕРИЧЕСКИХ РЕГУЛЯТОРОВ
Каждая субъединица гемоглобина несёт одну группу гемма, расположенную между F и E спиралями глобина. Атом Fe образует 4 связи с атомами азота пиррольных колец, одну связь с гистидином и одну связь с O2 или CO2.
Функционально гемоглобин может находиться в двух конформационных состояниях:
Высокоспиновое:
d-электроны расположены таким образом, чтобы число неспаренных электронов было максимальным. Диаметр атома больше и выступает над плоскостью гема. Атом железа имеет 5 связей и способен присоединять кислород.
Низкоспиновое:
d-электроны расположены таким образом, что число неспаренных электронов минимально. Атом железа имеет меньший радиус и находится в плоскости гема. Железо имеет 6 связей.
Переход в низкоспиновое состояние происходит при присоединении кислорода, это приводит к уменьшению радиуса атома железа и втягиванию его в плоскость гема. Это перемещение вызывает изменение всей конформации полипептидной цепи глобина. Конформационные изменения одной субъединицы вызывают изменения других субъединиц. Это приводит к тому, что атом железа втягивается в плоскость гема до присоединения кислорода, что вызывает повышение сродства гема к кислороду. Таким образом, присоединение последних атомов кислорода к гемоглобину происходит легче. Таким образом происходит кооперативное взаимодействие субъединиц гемоглобина.
Аллостерическая регуляция происходит аналогичным образом. Присоединение регулятора к ферменту вызывает комплекс конформационных перестроек, что приводит к изменению функциональной активности фермента, его активации.
ПРОГНОЗИРОВАНИЕ И ДИЗАЙН БЕЛКОВЫХ СТРУКТУР
Для расчёта пространственной структуры на основе АК последовательности используют два общих подхода:
Гомологичное моделирование
Создаётся база шаблонов первичной структуры и их структурообразующих свойств. Сходства последовательностей достаточно для сходства пространственной структуры.
Математическое моделирование
Производится расчёт структуры с минимальной свободной энергией или моделируется наиболее оптимальный процесс сворачивания структуры. Этот метод более точен, но требует намного больших вычислительных мощностей. Для него используются сети распределённого вычисления и суперкомпьютеры.
"Метод протягивания" заключается из предположения о том, что большинство вариантов третичной структуры уже известны. Производится перебор конформаций, расчёт их стабильности и выбор конформации с минимальной свободной энергией.
Направление белкового дизайна занимается моделированием белков с заданными свойствами. Главной проблемой этого направления является нестрогое соответствие между структурой и функциями белка. Существуют белки со схожей пространственной структурой, но выполняющие разную функцию, и наоборот.
Методы белкового дизайна подразделяются на: теоретические (основаны на знании соответствия между структурой и функциями АК последовательностей в реальных белках) и практические (основанные на методах точечных мутаций и синтеза искусственных белков).
ЗАКОНЫ ПОГЛОЩЕНИЯ ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ ВЕЩЕСТВОМ. СПЕКТРОФОТОМЕТРИЯ, ЕЁ ФИЗИЧЕСКИЕ ОСНОВЫ
Спектрофотометрия - это область физики исследующая распределение электромагнитного излучения по длинам волн или частотам.
В наиболее общем случае все спектрофотометрические методы основаны на анализе интенсивностей света разной длины волны поглощенного веществом или прошедшего через него. Атомы и молекулы имеют дискретные энергетические уровни. Если на вещество падает ЭМ волна, то энергия, равная разнице энергии перехода между энергетическими уровнями может поглощаться. При этом происходит снижение интенсивности излучения. Этот переход осуществляется с разной вероятностью при разных длинах волн.
Интенсивность поглощения, по закону Бугера-Ламберта-Бэра:![]() .
.
В этом соотношении интенсивность света, прошедшего через слой вещества экспоненциально зависит от толщины слоя и концентрации вещества.
Оптическая плотность вычисляется как десятичный логарифм отношения интенсивностей света до образца и после образца:![]()
Измеряя оптическую плотность раствора при определённых длинах волн можно определить концентрацию поглотителя в растворе. Также возможно построение спектра поглощения в определённом диапазоне длин волн, затем этот спектр можно использовать при качественном анализе состояния системы, конформационные переходы и химические превращения часто отражаются на форме спектра поглощения.
Спектрофотометрические методы часто делятся по диапазону используемых длин волн. Область спектрофотометрии в видимом диапазоне длин волн называют колориметрией.
Спектральное положение линии определяется разницей энергии состояний, между которыми осуществляется переход. ![]() Здесь они расположены в порядке уменьшения энергии. Энергиям электронных переходов соответствуют области спектра высоких энергий и высокой частоты, спектр поглощения энергии на увеличение колебательного и вращательного движения расположен в области с низкими частотами и низкой энергией.
Здесь они расположены в порядке уменьшения энергии. Энергиям электронных переходов соответствуют области спектра высоких энергий и высокой частоты, спектр поглощения энергии на увеличение колебательного и вращательного движения расположен в области с низкими частотами и низкой энергией.
Ширина спектральных линий определяется естественным уширением по причине грубости фиксирующих приборов. Также большую роль играют взаимодействия с другими частицами, доплеровское смещение частот за счёт теплового движения и изменение спектров за счёт межмолекулярных взаимодействий.
СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ В БИОФИЗИКЕ. ИХ ФИЗИЧЕСКИЕ ОСНОВЫ, ЗАДАЧИ СПЕКТРОСКОПИИ, КЛАССИФИКАЦИЯ СПЕКТРОСКОПИЧЕСКИХ
МЕТОДОВ
Спектроскопия - это область физики исследующая распределение электромагнитного излучения по длинам волн или частотам.
В наиболее общем случае все спектроскопические методы основаны на анализе интенсивности реакции вещества на воздействие опредлённой интенсивности и частоты. Этим воздействием могут являться ЭМ волны, магнитное поле, γ-лучи.
Атомы и молекулы имеют дискретные энергетические уровни. Если на вещество падает ЭМ волна, то энергия, равная разнице энергии перехода между энергетическими уровнями может поглощаться. При этом происходит снижение интенсивности излучения. Этот переход осуществляется с разной вероятностью при разных длинах волн.
Интенсивность поглощения, по закону Бугера-Ламберта-Бэра:![]() .
.
В этом соотношении интенсивность света, прошедшего через слой вещества экспоненциально зависит от толщины слоя и концентрации вещества.
Эта зависимость используется в спектрофотометрических методах.
В качестве воздействия может использоваться переменное магнитное поле высокой частоты, которое поглощается ядрами или электронами в постоянном магнитном поле. На этом основаны методы ЯМР и ЭПР.
γ-лучи используются в методе мессбауэровской спектроскопии, так как они могут поглощаться тяжёлыми атомами металлов.
Свойства спектральной линии.
Интенсивность определяется количеством поглотителя в исследуемом объекте.
Спектральное положение линии определяется разницей энергии состояний, между которыми осуществляется переход. ![]()
Ширина спектральных линий определяется естественным уширением по причине грубости фиксирующих приборов. Также большую роль играют взаимодействия с другими частицами, доплеровское смещение частот за счёт теплового движения и изменение спектров за счёт межмолекулярных взаимодействий.
Методами спектроскопии возможно изучение химического состава объектов, количественный анализ, а также структурный анализ, так как изменение структуры вещества часто отражается на характере его спектра.
МЕТОД ЭЛЕКТРОННОГО ПАРАМАГНИТНОГО РЕЗОНАНСА
Физические принципы и применение в изучении биополимеров.
Если внести частицу в определённым магнитным моментом в постоянное магнитное поле, то магнитный момент выстроится вдоль направления магнитного поля и будет прецессировать с частотой ![]() . Если теперь на частицу действовать слабым переменным магнитным полем, направленным перпендикулярно опорному полю, то при совпадении частоты переменного измерительного поля с частотой прецессии частицы, возникнет резонанс и сильное поглощение волны измерительного поля.
. Если теперь на частицу действовать слабым переменным магнитным полем, направленным перпендикулярно опорному полю, то при совпадении частоты переменного измерительного поля с частотой прецессии частицы, возникнет резонанс и сильное поглощение волны измерительного поля.
Электрон имеет спин ½, его энергетический уровень расщепляется на два, что соответствует переходу между спинами. В большинстве органических соединений спины электронов скомпенсированы и ЭПР не наблюдается. ЭПР наблюдается только у свободных радикалов и молекул с нечётным числом электронов, при этом, проявляются характеристические спектры, зависящие от электронного строения системы.
ЭПР используется при изучении реакций с участием свободных радикалов или белков, содержащих в качестве кофакторов атомы металлов с нескомпенсированным спином.
Также широко используется приём присоединения к исследуемым молекулам спиновых метоков и эффект Мессбауэра как анализатор.структуры атома, окружающих групп и характера цессии частицы, и частицы с чь слабым переменным магнитным полем, направленным перпендикулярно опорному полю, то при совпаде - свободных радикалов, содержащих неспаренный электрон. ЭПР спектр спин-метки зависит от её электронного окружения, конформации молекулы, к которой она присоединена.
МЕТОД ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА
Физические принципы и применение в изучении биополимеров.
Если внести частицу в определённым магнитным моментом в постоянное магнитное поле, то магнитный момент выстроится вдоль направления магнитного поля и будет прецессировать с частотой ![]() . Если теперь на частицу действовать слабым переменным магнитным полем, направленным перпендикулярно опорному полю, то при совпадении частоты переменного измерительного поля с частотой прецессии частицы, возникнет резонанс и сильное поглощение волны измерительного поля.
. Если теперь на частицу действовать слабым переменным магнитным полем, направленным перпендикулярно опорному полю, то при совпадении частоты переменного измерительного поля с частотой прецессии частицы, возникнет резонанс и сильное поглощение волны измерительного поля.
Ядерный спин имеют атомы, у которых нечётно хотя бы одно атомное число, массовое или порядковое. Ядерный спин равен нулю у ![]() и не равен нулю у
и не равен нулю у ![]()
При включении магнитного поля для протона возникают два уровня, соответствующие параллельному и антипараллельному направлениям спина. Частоту переменного поля увеличивают до тех пор, пока она не достигнет некого предела, выше которого резонанс невозможен, а интенсивность поглощения записывают. В результате получается спектр поглощения, который подвергается анализу. Сигналы ядер атомов, входящих в определенные функциональные группы, лежат в строго определенных участках спектра, а интегральная площадь, ограниченная пиком, строго пропорциональна количеству резонирующих атомов. Таким образом, можно получить количественные и качественные характеристики образца.
Одни и те же ядра атомов в различных окружениях в молекуле показывают различные сигналы ЯМР. Отличие такого сигнала ЯМР от сигнала стандартного вещества позволяет определить так называемый химический сдвиг, который обусловлен химическим строением изучаемого вещества. В методиках ЯМР есть много возможностей определять химическое строение веществ, конформации молекул, эффекты взаимного влияния, внутримолекулярные превращения. Это позволяет определить структуру окружения атомов и структуру самого вещества.
Используют также приёмы обогащения образцов контрастирующими метками, наблюдения процессов включения метки в состав объекта. Важным свойством метода является возможность его использования на живых биологических объектах.
Существует два метода ЯМР: метод постоянного поля и импульсный метод.
Частным случаем применения ЯМР является метод томографии или ЯМР-интроскопии, применяемый в-основном в медицине.
МЕТОД МЕССБАУЭРОВСКОЙ СПЕКТРОСКОПИИ
Его физические принципы и использование в изучении
биополимеров.
Этот метод основан на эффекте Мессбауэра, который заключается в поглощении атомным ядром монохроматического γ-излучения, испускаемого радиоактивным атомом. Образец подвергается действию γ-лучей, излучаемых радиоактивным железом ![]() .
.
Если сообщить источнику некоторую скорость движения относительно образца, то можно изменить частоту излучаемого γ-кванта за счёт эффекта Доплера. При некотором значении частоты, ядра образца будут поглощать γ-кванты, переходя в возбуждённое состояние. Метод используется при анализе свойств Fe-содержащих групп в белках. При этом, резонансная частота атома железа в группе сильно зависит от электронной структуры атома, окружающих групп и характера их взаимодействий. Эффект поглощения излучения усиливают путём обогащения образца изотопами железа, повышая, например, их содержание в пище подопытных животных. Также возможно применение γ-излучающих изотопов в качестве меченых атомов и эффект Мессбауэра как анализатор.
ИСПОЛЬЗОВАНИЕ ПОЛЯРИЗОВАННОГО СВЕТА В ИЗУЧЕНИИ БИОПОЛИМЕРОВ
Поляризованный свет содержит только электромагнитные волны с одной плоскостью колебания.
Свет может быть плоскополяризован (![]() обе фазы лежат в одной плоскости) или поляризован по кругу (
обе фазы лежат в одной плоскости) или поляризован по кругу (![]() фазы взаимно перпендикулярны).
фазы взаимно перпендикулярны).
Если взять 2 когерентные волны одинаковой амплитуды поляризованных по кругу и пропустить их через оптически активную среду, возможны разные эффекты:
Разное поглощение компонент. При разной степени поглощения право- и левополяризованных лучей - круговой дихроизм. Круговым дихроизмом обладают многие вещества обладающие свойствами жидких кристаллов, биологические полимеры.
Если при прохождении вещества правая и левая компоненты имеют разную скорость, то происходит круговое двулучепреломление. Это может быть связано с тем, что показатели преломления среды для право- и левополяризованной компоненты будут различны, будет происходить фазовый сдвиг компонентов и волны на выходе не будут когерентны.
Оптическое вращение (правое и левое) - есть поворот плоскостей поляризации при постоянной сумме этих компонентов. Эффектом оптического вращения обладают оптические изомеры молекул. При этом L и D изомеры поворачивают плоскость поляризации в разные стороны, но на один и тот же угол. Рацемические смеси не обладают свойством оптического вращения. Также этим свойством обладают α и β-структуры белков.
РЕНТГЕНОСТРУКТУРНЫЙ АНАЛИЗ
Его физические принципы и использование при изучении
биополимеров.
Рентгенография даёт прямую информацию о расположении атомов в молекулах и кристаллах. Рентгеновские лучи с длинами волн порядка 0,1нм рассеиваются электронными оболочками атомов. Дальнейшая интерференция этих волн приводит к возникновению дифракционной картины. Дифракция наблюдается, если рассеянные волны находятся в фазе, т.е. разность ходя равна целому числу волн. Условие дифракции даётся формулой Брэгга-Вульфа: ![]() и зависит от расстояния между кристаллическими плоскостями и угла падения луча. Рентгеноструктурный анализ заключается в определении расстояний между атомами на основании дифракционной картины.
и зависит от расстояния между кристаллическими плоскостями и угла падения луча. Рентгеноструктурный анализ заключается в определении расстояний между атомами на основании дифракционной картины.
Для рентгеноструктурного анализа необходимо сначала получить исследуемое вещество в кристаллической форме. Анализ рентгенограмм биологических молекул наиболее сложен, так как их кристаллические решётки имеют большое число отражающих плоскостей. Дифракционная картина представляет собой распределение интенсивности, по которому можно определить распределение электронной плотности объекта. Окончательным результатом рентгенографического исследования является пространственная модель, в которой определены положения всех атомов.
При анализе фибриллярных биополимеров получаются рентгенограммы, на которых дифракционные пятна располагаются преимущественно вдоль одной оси. Осевая структура рентгенограммы указывает на наличие одномерно упорядоченной системы. При анализе длинных цепных полимеров необходимо учитывать, что молекулы в кристалле могут находится в разной степени упорядоченности. В этом случае строят модель исследуемой системы, рассчитывают распределение интенсивностей рефлексов, а затем по совпадению модели с опытными данными судят об истинности модели. Таким способом была установлена пространственная модель ДНК.
Список использованной литературы
, Шабанова А.Н . Медицинский справочник. «Медицина» 1988. 233с.
Михайлов С.С. Анатомия человека, «Медицина», 1984 670с.
Энциклопедия-справочник «Человек», «РоссЛит», 1993, 397с.
Александров В.Н. Отравляющие вещества. М., 1969, 389с.
Лазарева Н.В. Вредные вещества в промышленности. /Под ред. и Левиной Э.Н. Л., 1977, 356с.
Тараховского М.Л . Лечение острых отравлений . Киев, 1982, 357с.
Шпаков А.О. Природные и бытовые яды. СПб., 2000, 289с.
Содержание
ВВЕДЕНИЯ……………………………………….………....……..5
ХИМИЧЕСКИЕ РЕАКЦИИ, КАК МОДЕЛЬ
КИНЕТИЧЕСКИХ ЗАКОНОМЕРНОСТЕЙ……………………...6
ОСОБЕННОСТИ КИНЕТИКИ БС:………………………………..7
КИНЕТИЧЕСКИЕ МОДЕЛИ БС……………………….…………8
ПОНЯТИЕ СТАЦИОНАРНОГО СОСТОЯНИЯ
В КИНЕТИКЕ БИОЛОГИЧЕСКИХ ПРОЦЕССОВ……………...9
КИНЕТИЧЕСКИЕ МОДЕЛИ, ОПИСЫВАЕМЫЕ ДВУМЯ
ДИФФЕРЕНЦИАЛЬНЫМИ УРАВНЕНИЯМИ…………………10
МОДЕЛЬ "ХИЩНИК - ЖЕРТВА"………………………………..13
МУЛЬТИСТАЦИОНАРНОСТЬ………………………….………..14
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ…………..……..15
ДИНАМИЧЕСКИЙ ХАОС. ЕГО ХАРАКТЕРИСТИКА….……..17
ПЕРВЫЙ И ВТОРОЙ ЗАКОНЫ ТЕРМОДИНАМИКИ……..…..18
ПРИНЦИПЫ ЭКСТРЕМУМОВ В
ТЕРМОДИНАМИКЕ. ИХ СУЩНОСТЬ
И ЗНАЧЕНИЕ……………………………………………………....22
ИЗМЕНЕНИЕ ЭНТРОПИИ В ОТКРЫТЫХ СИСТЕМАХ……...24
ПОНЯТИЕ ТЕРМОДИНАМИЧЕСКОГО
РАВНОВЕСИЯ. ОБЩИЕ СВОЙСТВА СИСТЕМ ВБЛИЗИ
ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ………………..…..25
ТЕРМОДИНАМИЧЕСКИЙ ПОДХОД
К АНАЛИЗУ СОПРЯЖЁННЫХ ПРОЦЕССОВ……………….....27
СКОРОСТЬ ПРОДУЦИРОВАНИЯ ЭНТРОПИИ
ВБЛИЗИ СТАЦИОНАРНОГО СОСТОЯНИЯ
СИСТЕМЫ. ТЕОРЕМА ПРИГОЖИНА……………………….….28
ОБЩИЕ СВОЙСТВА СИСТЕМ ВДАЛИ
ОТ ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ…………….….29
ИНФОРМАЦИЯ В БИОЛОГИИ……………………………….......32
ФЕНОМЕН БЕЛКА В БИОФИЗИКЕ. УНИКАЛЬНОСТЬ
СТРОЕНИЯ ИСВОЙСТВ БЕЛКА…………………………………33
ЭЛЕМЕНТАРНЫЕ ВЗАИМОДЕЙСТВИЯ В БЕЛКАХ…………..33
ЭЛЕМЕНТАРНЫЕ ВЗАИМОДЕЙСТВИЯ В БЕЛКАХ.
ВОДОРОДНЫЕ СВЯЗИ И
ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ. ИХ
ХАРАКТЕРИСТИКА…………………………………………….34
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА. ПЕПТИДНАЯ
СВЯЗЬ И ЕЁ СВОЙСТВА…………………………………….….34
ОБРАЗОВАНИЕ И РАЗРУШЕНИЕ
ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ
БЕЛКА С ПОЗИЦИИ ТЕОРИИ ФАЗОВЫХ
ПЕРЕХОДОВ………………………………………………..…….37
САМООРГАНИЗАЦИЯ БЕЛКА. ЭТАПЫ
САМООРГАНИЗАЦИИ БЕЛКА…………………………………40
МЕХАНИЗМЫ ФЕРМЕНТАТИВНОГО
КАТАЛИЗА НА ПРИМЕРЕ РАБОТЫ
СЕРИНОВЫХ ПРОТЕАЗ…………………………………..…….42
ВНУТРИМОЛЕКУЛЯРНАЯ ДИНАМИКА
БЕЛКА. ИЗМЕНЕНИЯ КОНФОРМАЦИИ
ГЕМОГЛОБИНА ПРИ ОКСИГЕНАЦИИ.
РОЛЬ АЛЛОСТЕРИЧЕСКИХ РЕГУЛЯТОРОВ………….…....44
ПРОГНОЗИРОВАНИЕ И ДИЗАЙН БЕЛКОВЫХ
СТРУКТУР…………………………………………..……………45
СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ В
БИОФИЗИКЕ. ИХ
ФИЗИЧЕСКИЕ ОСНОВЫ,
ЗАДАЧИСПЕКТРОСКОПИИ,КЛАССИФИКАЦИЯ СПЕКТРОСКОПИЧЕСКИХ
МЕТОДОВ………………………………………………..……..48
МЕТОД ЯДЕРНОГО МАГНИТНОГО
РЕЗОНАНСА…………………………………………………….50
ИСПОЛЬЗОВАНИЕ ПОЛЯРИЗОВАННОГО
СВЕТА В ИЗУЧЕНИИ БИОПОЛИМЕРОВ……………..…….53
РЕНТГЕНОСТРУКТУРНЫЙ АНАЛИЗ………………………..54
52