- Учителю
- Разработка лабораторных работ для проведения лабораторного практикума
Разработка лабораторных работ для проведения лабораторного практикума
ИЗМЕРЕНИЕ ПЛОТНОСТИ ВЕЩЕСТВА И оценка диаметра атома.
Почему плотности различных веществ различны? Для ответа на этот вопрос обратимся к формуле плотности: ρ=m/V
Масса тела складывается из масс частиц, из которых оно состоит. Другим словами, т = m0N (.N - общее число частиц). Тогда формула плотности принимает вид: ρ=m0N/V
N/V=n- число частиц в единице объема (концентрация). Итак ρ=т0п
Эта формула указывает на две причины различия плотностей веществ - различие в массах составляющих частиц и в их концентрации.
Как вам известно из курса химии (см. справочный отдел), масса частицы т =М/Nа
Измерив плотность вещества и зная массу частицы, можно определить концентрацию: п=ρ/т0
Определение плотности алюминиевого образца
Оборудование: весы, линейка, штангенциркуль, микрометр, алюминиевый брусок.
Ход работы
-
Определите с точностью до грамма (∆m = 1 г) массу т алюминиевого бруска.
-
Определите линейные размеры образца и рассчитайте объем бруска: V = l •d • h.
-
Рассчитайте плотность алюминия.
-
занесите все данные в таблицу
d,см
h,см
m, см
V,см3
ρ.,г/см3
5.Взяв табличное значение т0, оцените концентрацию атомов алюминия и их общее число в исследуемом образце.
</ Оценка диаметра атома алюминия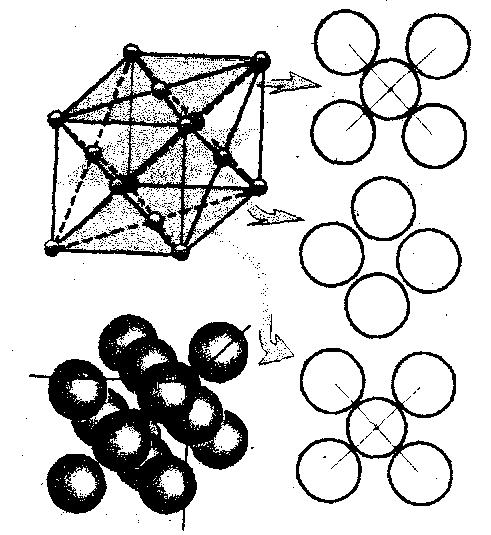
Если известна кристаллическая структура, определена плотность вещества, то можно оценить диаметр атома. Исследования показали, что алюминий имеет гране- центрированную кубическую структуру. Это означает, что центры атомов расположены в вершинах куба и центрах его граней.
Плотность алюминия равна: 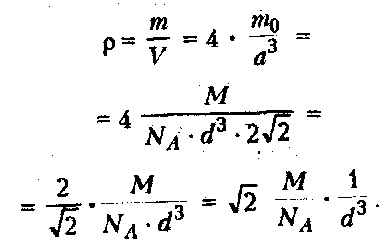
Пользуясь этим соотношением, можно оценить
диаметр атома алюминия: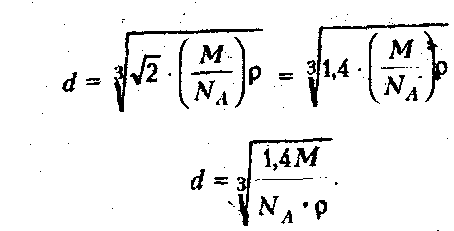
Выведем формулу, которая связывает диаметр атома
алюминия с плотностью. Для этого проведем плоскости через вершины
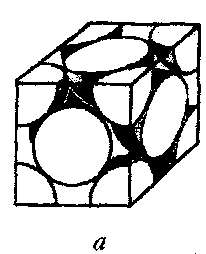
куба, в которых находятся центры атомов. Мы получим так называемую
элементарную ячейку (рис. а), одна грань которой изображена на рис.
6.
d2 + d2 = d2; а2 = 2d2; а = d • 2
Покажем, что в кубе со стороной а расположены 6 половинок атома - всего 3 атома. Еще один атом можно «собрать» из 8 «восьмушек», расположенных в вершинах куба. Итак, в кубе со стороной а находится 4 атома. Масса каждого атома: m0=M/Na
Ход работы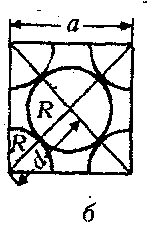
1.Взяв табличные данные для молярной массы алюминия и числа Авогадро, а также экспериментальное значение плотности, оцените диаметр атома алюминия.
2.Определите погрешность вычислений, сравнив полученное вами значение со значением диаметра атома алюминия d0 = 2,86 • 10 -8 см, известным из научных исследований.