- Учителю
- Конспект урока Агрегатные состояния вещества
Конспект урока Агрегатные состояния вещества
МОУ «Судская школа №1»
п. Суда Череповецкого района Вологодской области
Урок физики
8 класс
«Агрегатные состояния вещества»
Парфенова Елена Михайловна,
учитель физики и информатики,
1 квалификационная категория
2016 год
Конспект урока: «Агрегатные состояния вещества».
Дидактическая цель урока: создать условия для осознания и осмысления блока новой учебной информации, применения их в знакомой и новой учебной ситуациях, проверки уровня усвоения системы знаний и умений.
Задачи урока:
- познакомить учащихся с агрегатными состояниями вещества и процессами перехода между ними;
- развивать исследовательские навыки;
- создать условия для развития коммуникативных навыков в ходе совместной деятельности;
- выполнить тестовую работу на усвоение основных понятий урока.
-
Организационный момент. Взаимное приветствие учителя и учащихся, выявление отсутствующих, проверка подготовленности учащихся к уроку, организация внимания.
-
Целеполагание и мотивация.
Дидактическая задача - подготовить учащихся к работе на уроке.
Учитель: Сегодня ребята мы начинаем знакомиться с новой и достаточно интересной темой, а какой, вы узнаете, отгадав загадки. На протяжении всего занятия используется презентация. Приложение №1</</u>
- «Белое покрывало на земле лежало,
Лето пришло, оно все сошло» (снег)
- «Ну-ка в горсть ее схвати -
Не удержится в горсти» (вода)
- «Без крыльев летят,
Без ног бегут,
Без паруса плывут» (облака)
Вопрос: Скажите, что объединяет все ваши ответы?
Ученики: На всех рисунках изображено одно вещество - вода.
Вопрос: В чем отличие?
Ученики: вода находится в различных состояниях - твердом, жидком, газообразном.
Вопрос: о чем же мы сегодня будем говорить на уроке, как вы думаете?
Ученики: сегодня на уроке мы будем изучать агрегатные состояния вещества.
Учитель: правильно, сегодня мы повторим особенности строения веществ в различных агрегатных состояниях и познакомимся с переходами между ними. Работаем с опорными конспектами, тема урока: «Агрегатные состояния вещества».
Ученики: работают с опорными конспектами. Приложение №1.1
-
Актуализация знаний и умений.
Дидактическая задача - проверить знания учащихся, организовать и направить к цели познавательную деятельность учащихся.
Учитель: Как мы уже сказали, любое вещество, состоящее из атомов и молекул, может находиться в одном из 3-ёх агрегатных состояний - твердом, жидком или газообразном.
Вопрос: чем отличается одно агрегатное состояние вещества от другого?
Ученики: расположением молекул, взаимодействием молекул.
Вопрос: что мы можем сказать о молекулах одного и того же вещества в различных состояниях (на примере воды)? будет ли в них различие?
Ученики: молекулы одного и того же вещества в различных агрегатных состояниях одинаковы.
Вопрос: каковы особенности молекулярного строения газов, твердых тел и жидкостей?
Ученики: - в газообразном состоянии: молекулы слабо связаны друг с другом, поэтому перемещаются по всему объему с различными скоростями, расположены на больших расстояниях друг от друга, не сохраняют ни форму, ни объем;
- в жидком состоянии: молекулы не имеют строго определенной структуры, силы взаимодействия у них меньше, чем у молекул твердого тела, и поэтому они легко перемещаются, жидкости текучи, сохраняют объем и меняют форму;
- в твердом состоянии: молекулы расположены в строго определенном порядке, они не могут свободно перемещаться по телу, а лишь совершают колебательные движения около положения равновесия, сохраняют форму и объем)
Учитель: Мы знаем с вами, что вещество из одного агрегатного состояния может превращаться в другое состояние: Т→Ж→Г и наоборот, Г→Ж→Т. Давайте посмотрим, а как называются процессы перехода одного вещества в другое.
- Т→Ж- процесс перехода вещества из твердого состояния в жидкое наз. нагревание.
- Ж→Г - процесс перехода вещества из жидкого состояния в газообразное наз. парообразованием.
Оба эти перехода идут с увеличением внутренней энергии, т.к. вещество поглощает тепло.
Точно такие же процессы мы можем проследить и в обратном направлении:
- Г→Ж - для этого необходимо только охладить пар - процесс превращения вещества из газообразного состояния в жидкое наз. конденсация («конденсаре» - сгущать).
- Ж→Т - процесс превращения вещества из жидкого состояния в твердое наз. отвердевание (кристаллизация).
Оба эти перехода идут с уменьшением внутренней энергии, т.к. вещество при охлаждении выделяет тепло.
С этими процессами мы регулярно встречаемся в повседневной жизни. Но иногда бывает так, что вещество из твердого состояния переходит в газообразное, минуя при этом жидкое состояние и наоборот, вещество из газообразного состояния переходит в твердое, минуя жидкое состояние. Эти переходы называются соответственно сублимация (возгонка) и десублимация. Эти переходы происходят довольно редко и лишь с некоторыми веществами. Наиболее распространенным примером вещества, которое может из твердого состояния перейти в газообразное и наоборот, является ЙОД.
Ученик делает доклад об одном наиболее известном веществе йоде, Приложение №2 дает его оценку с физической и химической точки зрения, говорит о важности йода для организма человека и использовании его в медицинских целях.
Учитель: вот мы и вспомнили с вами основные состояния вещества, переходы между ними, а теперь от теории перейдем к практике.
-
Применение знаний и умений.
Дидактическая задача - развивать у учащихся исследовательские и коммуникативные навыки в ходе совместной деятельности.
Учитель: Каждая пара (группа) получает карточку с заданием, которое вам предстоит выполнить. Приложение №4 Ваши работы в конце урока соберу и оценю. Оборудование для выполнения работы выберите самостоятельно (лотки с оборудованием пронумерованы согласно номеру задания)
Но прежде, чем начинать работу над заданием вам необходимо вспомнить технику безопасности при проведении эксперимента.
Ученики (по очереди): - у спиртовки аккуратно открыли крышку, подожгли фитилек, по завершении эксперимента прикрыли огонек крышечкой;
- горлышко пробирки на себя не направлять, в начале использования пробирки ее необходимо нагреть над огнем равномерно;
- пальцем температуру воды не проверять;
- горячие части приборов голыми руками не трогать (для этого есть держатели).
Учитель: сейчас не вставая со стула, наклоняясь только вправо или влево, достаньте листочек с номером задания (он с нижней стороны стула), потихонечку встаньте, возьмите лоток с вашим номером и выполняйте работу. На все про все у вас 15 минут. Если есть вопросы, то поднимите руку, и я подойду, но помните, что каждый мой подход к вам снижает оценку на 0,5 балла. Удачи!
Ученики: аккуратно достают из-под стула номер с заданием, формируются в группы и начинают выполнять работу.
Учитель: пока ученики выполняют работу, раздает таблички с вопросами (для рефлексии).
-
Проверка уровня усвоения знаний и умений.
Дидактическая задача - установить, усвоили или нет учащиеся содержание новых понятий, закрепить новые знания.
Учитель: сейчас я вам предлагаю еще раз вспомнить, что мы изучили сегодня на уроке и выполнить небольшой тест на компьютере.
Ученики: выполняют тестовую работу (учитель может сформировать тест из 5 вопросов по уже изученной теме)
Учитель: оценку, которую получили за тест, поставьте себе в тетрадь.
-
Домашнее задание.
Дидактическая задача - сообщить учащимся о домашнем задании и пояснить его.
§12, для подготовки дом задания вам поможет опорный конспект.
-
Из литературных произведений (стихотворений) любых авторов выбрать минимум 5 отрывков, в которых говорится об агрегатных состояниях вещества (Например, «Белая береза под моим окном, принакрылась снегом, точно серебром…» - снег - твердое состояние вещества);
-
На оценку написать сказку, которая начинается со слов: «Жила - была молекула…»
Задание на выбор.
-
Рефлексия.
1. На уроке я работал
активно / пассивно
2. Своей работой на уроке я
доволен / не доволен
3.Урок для меня показался
коротким / длинным
4. За урок я
не устал / устал
5. Материал урока мне был
понятен / не понятен
полезен / бесполезен
интересен / скучен
6.Домашнее задание мне кажется
легким / трудным интересным / неинтересным
Тетради домашние сдать на поверку. Урок окончен. До свидания!
Используемая литература:
-
Перышкин А.В. Физика. 8 кл.: Учебник для общеобразовательных учебных заведений. - М.: Дрофа, 2010.
-
Материалы Интернета (видеоролик «Возгонка йода» и информация о йоде)
Приложение 1.1
Опорный конспект
Тема урока «____________________________________»
_____________________________________________
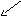

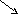
__________________ ___________________
________________
Т
 Ж Г
Ж Г


Г
 Ж Т
Ж Т


Сублимация (возгонка) - _____________________________
__________________________________________________ .
Десублимация - _____________________________________
__________________________________________________ .
Д.з. §12, На выбор: 1.Из литературных произведений (стихов) любых авторов выбрать минимум 5 отрывков, в которых говорится об агрегатных состояниях вещества;
2. На оценку написать сказку, которая начинается со слов: «Жила - была молекула…».
Приложение 2.
Йод.
История открытия.
В 1811 году французским рабочим Бернардом Куртуа был получен свободный йод. Произошло это так. У Куртуа были приготовлены в двух разных бутылках смеси веществ. В одной - серная кислота с железом, а в другой зола морских водорослей со спиртом. На плече рабочего сидел кот. Вдруг кот прыгнул и опрокинул содержимое бутылок. Вещества смешались, и от них стали подниматься клубы фиолетового пара, образовывающие при оседании кристаллы с металлическим блеском и едким запахом. Это был йод. Куртуа не смог в деталях исследовать новый элемент, это сделали другие ученые. А название ему дал в 1831 году Гей-Люссак: «йод» в переводе с греческого означает «цвет фиалки». Красивые темно-синие кристаллы йода больше всего похожи на графит.
Физические свойства.
Йод при комнатной температуре представляет собой темно - фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в фиолетовый пар; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Это используют на практике для очистки йода от нелетучих примесей. Мало растворим в воде, хорошо во многих органических растворителях.
Особенности.
Йод очень распространенный и очень рассеянный элемент. Он содержится буквально во всех горных породах. Но людям не известны руды йода - горные породы, содержащие его в значительном количестве. Йод растворен в воде морей и океанов, встречается даже в воздухе (особенно много на побережьях).
Добывают йод из водорослей. В домашних аптечках у многих хранится пузырек с темно-коричневой жидкостью, обладающей характерным запахом. Это не йод, а йодная настойка - 5-10% раствора йода в спирте.
Йод необходимый для жизни элемент. Он содержится в щитовидной железе, регулирующей развитие человека. Впрочем, йод полезен только в небольших количествах.
Приложение 4.
Примерное оборудование необходимое для выполнения заданий
-
Стаканы металлические, лед, плитка электрическая, блюдце или тарелка.
-
Стаканы металлические, лед, плитка электрическая, блюдце.
-
Стаканы металлические, снег, вода, весы электронные, плитка электрическая, термометры, секундомер (часы).
-
Стаканы металлические, снег, вода, весы электронные, плитка электрическая, термометры, секундомер (часы).
-
Пробирка стеклянная, вода, плитка электрическая, стакан металлический с водой, держатель.
Задание №1
Проследите за превращениями воды из твердого состояния в газообразное. Предложите способ превращения пара в жидкость. Проверьте этот способ на опыте.
Задание №2
Проследите за превращениями льда в пар. Может ли вещество находиться в трех состояниях одновременно?
Задание №3
Поставьте на электрическую плитку два одинаковых стакана; в один налейте 50 гр воды, а в другую положите снег той же массы. Измерьте начальную температуру воды и снега, а также время, которое потребуется, чтобы вода в обоих стаканах закипела. Объясните полученные значения. Может ли вещество находиться в двух состояниях одновременно?
Задание №4
Поставьте на электрическую плитку два одинаковых стакана; в один налейте 50 гр воды, а в другую положите снег той же массы. Измерьте начальную температуру воды и снега, а также время, которое потребуется, чтобы вода в обоих стаканах закипела. Объясните результат.
Задание №5
Удастся ли вскипятить воду в пробирке, опустив ее в сосуд с кипящей водой? Проверить на опыте. Объяснить результат.
8