- Учителю
- Методическая разработка урока физики по теме: 'Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам'
Методическая разработка урока физики по теме: 'Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам'
Автономное учреждение
профессионального образования
Ханты-Мансийского автономного округа - Югры
«СУРГУТСКИЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ»
Методическая разработка урока физики по теме:
«Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам»
Должность
Фамилия/ подпись
Дата
Разработал
Преподаватель физики
Кузмауль М. С.
Проверил
Сургут, 2015
ТЕМА УРОКА
Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам
Цель: ввести первый закон термодинамики как закон сохранения энергии термодинамической системы, раскрыть его физическое содержание при рассмотрении изопроцессов, сформировать умения использовать первый закон термодинамики для описания газовых процессов.
Задачи:
образовательные: изучить первый закон термодинамики как закон сохранения энергии термодинамической системы, раскрыть его физическое содержание при рассмотрении конкретных процессов, ввести понятие об изотермическом, изобарном, изохорном, адиабатном процессе, сформировать умения использовать первый закон термодинамики для описания газовых процессов.
развивающие: развить навыки применения первого закона термодинамики при решении задач, научить составлять алгоритм решения задач, развить познавательного интерес.
воспитывающие: воспитывать мировоззрение учащихся на основе метода научного познания природы.
Оборудование к уроку: мультимедийный проектор, экран, таблица, пробирка с пробкой , термометр, вода, лист бумаги, таблица "удельная теплоемкость различных веществ".
Тип урока: комбинированный
Методы ведения урока: письменный опрос, беседа, метод алгоритмизации, использование ИКТ.
План урока.
Этапы урока
Время, мин.
Приёмы и методы
1. Организационный момент
3
2. Проверка знаний
20
Письменный опрос, практическая работа.
3. Изучение новой темы
25
Рассказ, демонстрации, записи в тетрадях, диалог
4. Закрепление материала (Решение задач)
22
Решение задач, ответы на вопросы
5. Рефлексия
5
Ответы на вопросы
6. Домашнее задание с комментариями
5
Заранее записано на доске
Ход урока
-
Организационный момент урока.
- Здравствуйте, сегодня мы продолжаем изучение главы «Основы термодинамики». Для начала повторим изученный материал прошлого урока, затем перейдём к изучению нового материала.
2. Проверка знаний по темам: "Кристаллические и аморфные тела. Внутренняя энергия. Способы изменения внутренней энергии":
I. Провести письменный опрос на 2 варианта (заранее подготовлены чистые листочки на партах):
1 вариант
2 вариант
1. Что такое кристаллические тела?
1. Что такое аморфные тела?
2. Перечислите свойства кристаллических тел.
2. Перечислите свойства аморфных тел.
3. На доске приведен список различных тел: эбонит, жемчуг, пластмасса, алмаз, соль, стекло, каучук, графит, полиэтилен, янтарь, сода.
выбрать из списка аморфные тела
Ответ: эбонит, пластмасса, стекло, каучук, полиэтилен.
выбрать из списка кристаллические тела
Ответ: алмаз, соль, жемчуг, сода, графит
4. Общее задание (для всех вариантов) - объяснить на основе проведенного опыта наблюдаемые явления:
«Изменение внутренней энергии тела»
Опыт № 1. Приборы и материалы: 1) пробирка химическая, закрытая пробкой; 2) термометр; 3) цилиндр измерительный с носиком 100 мм с холодной водой; 4) лист бумаги; 5) таблица «Удельная теплоемкость веществ».
Порядок выполнения работы
-
Налейте в пробирку немного воды (8-10 г) и измерьте ее температуру.
-
Закройте пробирку пробкой и заверните в бумагу. Энергично встряхивайте воду в пробирке в течение 30-40 с.
-
Откройте пробирку и снова измерьте температуру воды.
-
Вычислите изменение внутренней энергии воды.
-
Результаты измерений и вычислений запишите в тетрадь.
-
Ответьте на вопросы:
- Как изменялась внутренняя энергия воды во время опыта?
- Каким способом вы изменяли внутреннюю энергию воды в опыте?
- Зачем пробирку с водой необходимо было заворачивать в бумагу во время опыта?
- Что можно сказать о зависимости изменения внутренней энергии тела от совершенной работы?
Опыт №2. Потрите ладони друг об друга. Что вы чувствуете? Почему ладони греются? (учащиеся объясняют, что внутренняя энергия изменяется за счёт совершения работы).
3. Изучение нового материала.
1). Повторить материал о внутренней энергии, способах изменения внутренней энергии и формулы расчета количества теплоты. Систематизировать материал темы в виде схемы, ответив на вопросы:
-
Что называем внутренней энергий?
-
Какими способами можно изменить внутреннюю энергию?
-
Что называется работой?
-
Что называем количеством теплоты?
-
Назовите процессы, сопровождающиеся выделением и поглощением тепла.
нагревание (охлаждение)
парообразование (конденсация)
плавление (кристаллизация)
сгорание топлива
2). Изучение новой темы
Устная информация:
К середине XIX в. многочисленные опыты доказали, что механическая энергия никогда не пропадает бесследно. Падает, например, молот на кусок свинца, и свинец нагревается вполне определенным образом. Силы трения тормозя тела, которые при этом разогреваются
На основании множества подобных наблюдений и обобщения опытных фактов был сформулирован закон сохранения энергии:
Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
Закон сохранения энергии управляет всеми явлениями природы и связывает их воедино. Он всегда выполняется абсолютно точно, неизвестно ни одного случая, когда бы этот великий закон не выполнялся.
Этот закон был открыт в середине XIX в. немецким ученым, врачом по образованию Р. Майером (1814-1878), английским ученым Д. Джоулем (1818-1889) и получил наиболее точную формулировку в трудах немецкого ученого Г. Гельмгольца (1821 - 1894).
Закон сохранения и превращения энергии, распространенный на тепловые явления, носит название первого закона термодинамики.
В термодинамике рассматриваются тела, положение центра тяжести которых практически не меняется. Механическая энергия таких тел остается постоянной, изменяться может лишь внутренняя энергия каждого тела.
Под запись:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
∆U=A+Q.
Часто вместо работы А внешних тел над системой рассматривают работу А' системы над внешними телами. Учитывая, что А'=-А, первый закон термодинамики можно записать так:
Q=∆U+A′
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К РАЗЛИЧНЫМ ПРОЦЕССАМ
Учащиеся записывают в виде таблицы полученную информацию от преподавателя.
(Комментарий: форма таблицы роздана на парты заранее, преподаватель работает с доской.).
Название процесса
Постоянный параметр
График
Запись закона
Физический смысл записи первого закона
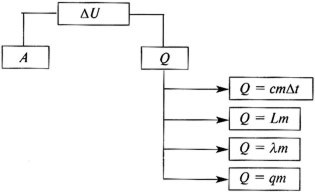
Изотермический
Т=const
Q=A'
Всё переданное газу тепло идёт на совершение им же работы
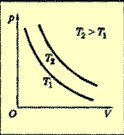
Изохорный
V = const
∆U=Q
Все переданное газу количество теплоты идет на совершение работы
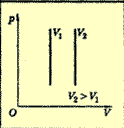
Изобарный
P = const
Q=∆U+A′
или
∆U=A+Q
Смотреть формулировку 1 закона термодинамики.
Адиабатный
Q = const
∆U=A
Изменение внутренней энергии происходит только за счет совершения работы
С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин остается неизменной (изопроцессы). Пусть система представляет собой идеальный газ. Это самый простой случай.
Изотермический процесс.
При изотермическом процессе (Т=const) внутренняя энергия идеального газа не меняется. Согласно формуле все переданное газу количество теплоты идет на совершение работы: Q=A'.
Если газ получает теплоту (Q>0), то он совершает положительную работу (А'>0). Если, напротив, газ отдает теплоту окружающей среде (термостату), то Q<0 и А'<0. Работа же внешних сил над газом в последнем случае положительна.
Изохорный процесс.
При изохорном процессе объем газа не меняется, и поэтому работа газа равна нулю. Изменение внутренней энергии равно количеству переданной плоты: ∆U=Q.
Если газ нагревается, то Q>0 и ∆U>0, его внутренняя энергия , увеличивается. При охлаждении газа Q<0 и ∆U=U2-Ul<0, изменение внутренней энергии отрицательно и внутренняя энергия газа уменьшается.
Изобарный процесс.
При изобарном процессе (P = const) передаваемое газу количество теплоты идет на изменение его внутренней энергии и на совершение им работы при постоянном давлении.
Q=∆U+A′
Адиабатный процесс.
Рассмотрим теперь процесс, протекающий в системе, которая не обменивается теплотой с окружающими телами.
Процесс в теплоизолированной системе называют адиабатным.
При адиабатном процессе Q=0 и согласно уравнению изменение внутренней энергии происходит только за счет совершения работы:
∆U=A.
Конечно, нельзя окружить систему оболочкой, абсолютно не допускающей теплопередачу. Но в ряде случаев можно считать реальные процессы очень близкими к адиабатным. Для этого они должны протекать достаточно быстро, так, чтобы за время процесса не произошло заметного теплообмена между системой и окружающими телами.
4. Закрепление (Решение задач).
Рассмотрим различные примеры задач на использование и применение первого закона термодинамики
Тип задач
Условие задачи
Решение
Примечания
Расчетный (количественный)
В закрытом баллоне находится газ. При охлаждении его внутренняя энергия уменьшилась на 500 кДж. Какое количество теплоты отдал газ? Совершил ли он работу?
Дано: ΔU = -500 Дж;
Найти: Q - ? А - ?
V = const - изохорный процесс
1) ∆U=Q - 1 закон термодинамики для нашего условия.
Q = -500 Дж
2) Т. к. объём не меняется: А = Р ΔV → А = 0 - газ работу не совершает.
Ответ: Q = -500 Дж; А = 0
знак «-» показывает, что газ выделяет количество теплоты
Задача-вопрос (качественный)
В сосуд, на дне которого была вода, накачали воздух. Когда открыли кран и сжатый воздух вырвался наружу, сосуд заполнился водяным туманом. Почему это произошло?
Если открыть кран, то воздух начнет расширяться и выходить наружу. Данный процесс происходит очень быстро и его можно рассматривать как адиабатное расширение. А при адиабатном расширении согласно первому закону термодинамики внутренняя энергия газа уменьшается а значит и температура уменьшается. При понижении температуры пар в сосуде становится насыщенным и происходит конденсация
Чтение условия, анализ задачи (использование общих закономерностей) и решение.
Вспомнить что такое конденсация, насыщенный пар.
Графический
Идеальный газ переходит из состояния 1 в состояние 4 так, как показано на рисунке. Вычислите работу, совершаемую газом.
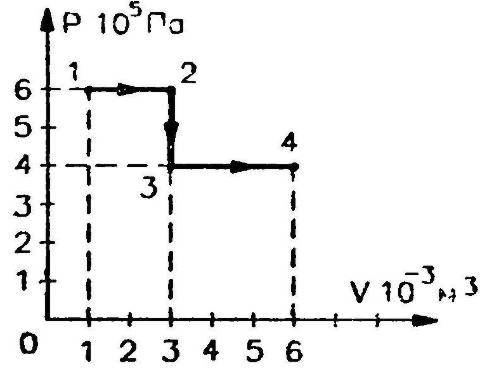
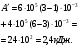
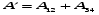
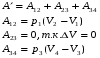
Вся работа, совершенная газом равна сумме работ на отдельных участках.
Для определения работы на каждом участке графика определяем:
какой параметр постоянный, исходя из этого определяем запись 1 закона термодинамики к данному процессу
На основе рассмотренных примеров решения задач учащиеся пытаются составить общий алгоритм решения задач. Затем преподаватель включается в деятельность и совместно с учащимися вносит корректировки в составление алгоритма.
Общий алгоритм решения задач по термодинамике
1. Внимательно прочитать условие задачи, определить тип задачи;
2. Записать краткое условие задачи;
3. Перевести единицы измерения в СИ (если требуется);
4. Определить параметры p,V и T, характеризующие каждое состояние газа. Записать 1 закон термодинамики для необходимого процесса, дополнительные формулы, если потребуются (для расчета внутренней энергии, работы, количества теплоты, газовые законы);
6. Провести математические преобразования и расчёты;
7. Проанализировать полученный результат и записать ответ.
5. Рефлексия
Сегодня на уроке мы изучили первый закон термодинамики, раскрыли его физическое содержание при рассмотрении изопроцессов - изотермического, изобарного, изохорного, адиабатного, научились использовать первый закон термодинамики для описания газовых процессов.
Оцените сегодняшний урок:
На уроке я работал
активно/пассивно
Урок для меня показался
коротким/длинным
Материал урока мне был
понятен/не понятен
Моё настроение
стало лучше/ стало хуже
Домашнее задание мне кажется
лёгким/трудным
6. Домашнее задание: изучить § 78, 79, выучить конспект в тетради, выполнить упр.15 (№7,8)
Список литературы:
-
Каменецкий С.Е., Орехов В.П. Методика решения задач по физике в средней школе: Пособие для учителей. - М.: Просвещение, 1971. - 448 с.
-
Мякишев, Г.Я. Физика. 10 класс: учебник для общеобразоват. учреждений с прил. на электрон. носителе: базовый и профил. уровни / Г.Я. Мякишева, Б.Б. Буховцев, Н.Н. Сотский; под ред. В.И. Николаева, Н.А. Парфентьевой. - 20-е изд. - М.: Просвещение, 2011. -366 с.: ил. - (Классический курс).
-
Рымкевич А.П. Сборник задач по физике. /10-е изд., стереотип. - М.: Дрофа, 2006. - 188 с
-
Усова А.В. Практикум по решению физических задач: пособие для студентов физ.-мат. ф-тов/ А.В. Усова, Н.Н. Тулькибаева. - М.: Просвещение, 2001. - 208 с.
Интернет-ресурсы по физике:
-
-
.
-
-
-
http://www. physicon. ru/
Приложение 1
Задания для письменной работы учащихся
1 вариант
2 вариант
1. Что такое кристаллические тела?
1. Что такое аморфные тела?
2. Перечислите свойства кристаллических тел.
2. Перечислите свойства аморфных тел.
3. На доске приведен список различных тел: эбонит, жемчуг, пластмасса, алмаз, соль, стекло, каучук, графит, полиэтилен, янтарь, сода.
выбрать из списка аморфные тела
Ответ: эбонит, пластмасса, стекло, каучук, полиэтилен.
выбрать из списка кристаллические тела
Ответ: алмаз, соль, жемчуг, сода, графит
4. Общее задание (для всех вариантов) - объяснить на основе проведенного опыта наблюдаемые явления:
«Изменение внутренней энергии тела»
Опыт № 1. Приборы и материалы: 1) пробирка химическая, закрытая пробкой; 2) термометр; 3) цилиндр измерительный с носиком 100 мм с холодной водой; 4) лист бумаги; 5) таблица «Удельная теплоемкость веществ».
Порядок выполнения работы
-
Налейте в пробирку немного воды (8-10 г) и измерьте ее температуру.
-
Закройте пробирку пробкой и заверните в бумагу. Энергично встряхивайте воду в пробирке в течение 30-40 с.
-
Откройте пробирку и снова измерьте температуру воды.
-
Вычислите изменение внутренней энергии воды.
-
Результаты измерений и вычислений запишите в тетрадь.
-
Ответьте на вопросы:
- Как изменялась внутренняя энергия воды во время опыта?
- Каким способом вы изменяли внутреннюю энергию воды в опыте?
- Зачем пробирку с водой необходимо было заворачивать в бумагу во время опыта?
- Что можно сказать о зависимости изменения внутренней энергии тела от совершенной работы?
Опыт №2. Потрите ладони друг об друга. Что вы чувствуете? Почему ладони греются? (учащиеся объясняют, что внутренняя энергия изменяется за счёт совершения работы).
Приложение 2
Схема «Внутренняя энергия. Способы изменения внутренней энергии»
нагревание (охлаждение)
парообразование (конденсация)
плавление (кристаллизация)
сгорание топлива

Приложение 3
Таблица «Применение первого закона термодинамики к изопроцессам»
Название процесса
Постоянный параметр
График
Запись закона
Физический смысл записи первого закона
Изотермический
…=const

Изохорный
…= const

Изобарный
… = const

Адиабатный
…= const
