- Учителю
- Применение 1 закона термодинамики к изопроцессам
Применение 1 закона термодинамики к изопроцессам
Применение I закона ТЕРМОДИНАМИКИ к различным изопроцессам
изопроцесс
график изопроцесса
запись 1 закона термодинамики
∆U
физический смысл
</ 1.Изохорное нагревание,
V = const
Процесс происходит, когда газ заключен в жёсткую теплопроводящую оболочку.

 p QV
> 0
p QV
> 0
 QV
A'V = 0
QV
A'V = 0


 0 V
0 V
(A' = p∙∆V; ∆V = 0, => A' = 0)
∆U = QV
∆U > 0
Внутренняя энергия газа увеличивается за счёт полного поглощения подводимой теплоты.
2.Изохорное охлаждение,
V = const
Процесс происходит, когда газ заключён в жесткую теплопроводящую оболочку.

 p QV
< 0
p QV
< 0

 A'V =
0
A'V =
0
 QV
QV
0 V
(A'= p∙∆V; ∆V = 0, => A' = 0 )
∆U = QV
∆U < 0
Внутренняя энергия газа уменьшается за счёт передачи газом энергии при теплообмене.
3.Изобарное расширение (нагревание), p = const
∆V > 0, A'p = p∙∆V > 0,
∆V ˜ ∆T, то
∆V > 0 и ∆T > 0; => ∆U > 0.
Отсюда, Qp > 0, причём, Qp > A'p
p
 Qp QP
> 0,
Qp QP
> 0,




 A'P
A'P > 0,
A'P
A'P > 0,
 QP
> A'P ,
QP
> A'P ,
0 V
AP < 0
при Qp > A'p
∆U = Qp + Ap
(∆U = Qp - A'p)
Qp = ∆U + A'p
(Qp = ∆U - Ap)
∆U > 0
Количество теплоты, сообщаемое газу при изобаном нагревании, расходуется частично на увеличение вну-тренней энергии газа и частично на совершение рабо-ты газом при его расширении. Причем, в общем случае количество теплоты, сообщенное телу, не равно уве-личению его внутренней энергии .Энергия, сообщаемая газу путем теплообмена, превосходит энергию, отда-
ваемую газом путем совершения работы (Qp>Ap),что приводит к увеличению внутренней энергии и повыше-нию температуры газа.
4.Изобарное сжатие (охлаждение), p = const
∆V < 0, A'p = p∙∆V < 0,
и ∆V ˜ ∆T, то ∆T < 0,
и ∆V < 0; => Qp < 0.
т.к. Ap = - p∙∆V, то Ap > 0,
|Qp| > Ap
 p QP
< 0,
p QP
< 0,
 Ap
Ap



 AP
> 0,
AP
> 0,
 Qp
Qp
QP < A'P,
-
V
A'P < 0
при Qp < A'p
∆U = Qp + Ap
(∆U = Qp - A'p)
Qp=∆U+A'p
(Qp=∆U-Ap)
∆U < 0
При изобарном охлаждении газ отдает часть своей внутренней энергии путем теплообмена и одновреме-енно приобретает энергию путем совершения рабо-ты над газом. При этом энергия, отдаваемая газом путем теплообмена, превосходит энергию, приобре-таемую газом путем совершения работы (|Qp|>A), что приводит к уменьшению внутренней энергии и понижению температуры газа.
изопроцесс
график изопроцесса
запись 1 закона термодинамики
∆U
физический смысл
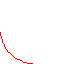
5.Изотермическое
расширение, T = const.
Процесс может протекать только при наличии тепло-обмена.
p
 QТ
AT < 0
QТ
AT < 0



 QТ =
A'T QT < 0
QТ =
A'T QT < 0
-
V A'T < 0
QТ = -AТ
QТ = A'Т
∆U = 0
Внутренняя энергия газа остается без изменения за счёт того, что при изотермическом расшире-нии газ отдает энергию в окружающую среду путём совершения работы, равной энергии, при-обретаемой газом путем теплообмена.
6. Изотермическое
сжатие, T = const.
Процесс может протекать только при наличии тепло-обмена.AT > 0
QТ < 0
A'T > 0
p

 AT
AT

 QТ =
A'T
QТ =
A'T

-
V
QТ = -AТ
QТ = A'Т
∆U =0
Внутренняя энергия газа остается без изменения за счёт того, что энергия, приобретаемая газом при изотермическом сжатии путём совершения работы, равно энергии, отдаваемой газом путём теплообмена.
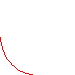
7. Адиабатное расширение.
Процесс, происходящий при отсутствии теплообмена между термодинамической системой и окружающей средой, называют адиабат-ным.
p
 Qа =
0, Tа - понижается
Qа =
0, Tа - понижается
 A'a
A'a
 Aа
< 0
Aа
< 0
 A'а
> 0
A'а
> 0
0 V
∆U = Aa
∆U = -A'a
∆U < 0
При адиабатном расширении находящегося в ци-линдре газа путем выдвигания поршня скорости, а значит, и кинетические энергии молекул, упруго отражающихся от удаляющегося поршня, будут меньшими, нежели при отражении от неподви-жного поршня.Отсюда следует, что внутренняя энергия, а значит, и температура газа уменьша-ются за счёт совершения работы газом.
8. Адиабатное сжатие.
Процесс, происходящий при отсутствии теплообмена между термодинамической системой и окружающей средой, называют адиабат-ным.
p Qа =
0, Tа - повышается
Qа =
0, Tа - повышается

 Аа
Аа
 Aа
> 0
Aа
> 0

 A'T
< 0
A'T
< 0
0 V
∆U = Aа
∆U = - A'а
∆U > 0
При адиабатном сжатии находящегося в цилин-дре газа путём выдвигания поршня скорости, а значит, и кинетические энергии молекул газа уп-руго отражающихся от приближающегося пор-шня, будут большими,нежели при отражении от неподвижного поршня. В результате молекулы газа приобретают дополнительную энергию, за счёт которой увеличивается внутренняя энер-гия, a следовательно, и температура газа.