- Учителю
- конспект урока по физике 'ПОЛУЧЕНИЕ РАДИОАКТИВНЫХ ИЗОТОПОВ И ИХ ПРИМЕНЕНИЕ' (11 класс)
конспект урока по физике 'ПОЛУЧЕНИЕ РАДИОАКТИВНЫХ ИЗОТОПОВ И ИХ ПРИМЕНЕНИЕ' (11 класс)
Урок _____
ПОЛУЧЕНИЕ РАДИОАКТИВНЫХ ИЗОТОПОВ И ИХ ПРИМЕНЕНИЕ
Цель:_________________________________________________________________________________________________________________________________________________________________________________________________
Задача:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ход урока
I . Мотивация .
II . Актуализация знаний. (слайд 2-3)
-
Как иначе называется и каким символом обозначается ядро атома водорода? Каковы его масса и заряд? (символом
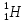 обозначен протон, т. е. ядро атома водорода, с массой, приблизительно равной 1 а. е. м. (точнее, 1,0072765 а. е. м.), и положительным зарядом, равным элементарному (т. е. модулю заряда электрона). Для обозначения протона используют также символ
обозначен протон, т. е. ядро атома водорода, с массой, приблизительно равной 1 а. е. м. (точнее, 1,0072765 а. е. м.), и положительным зарядом, равным элементарному (т. е. модулю заряда электрона). Для обозначения протона используют также символ 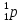 .)
.) -
Какое предположение (относительно состава ядер) позволяли сделать результаты опытов по взаимодействию α-частиц с ядрами атомов различных элементов? (протоны входят в состав ядер атомов всех химических элементов.)
-
К какому противоречию приводит предположение о том, что ядра атомов состоят только из протонов? Поясните это на примере. (Если считать, что атомные ядра состоят только из протонов)
-
Кем впервые было высказано предположение о существовании электрически нейтральной частицы с массой, приблизительно равной массе протона? (Резерфордом)
-
Кто и когда первым доказал, что бериллиевое излучение представляет собой поток нейтронов? (В 1932 г. английский ученый Джеймс Чедвик)
-
Как было доказано отсутствие у нейтронов электрического заряда? Как была оценена их масса? (с помощью опытов, проведенных в камере Вильсона, массу частиц удалось оценить по их взаимодействию с другими частицами)
-
Как обозначается нейтрон, какова его масса по сравнению с массой протона? (Нейтрон принято обозначать символом
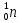 . Точные измерения показали, что масса нейтрона равна 1,0086649 а. е. м., т. е. чуть больше массы протона. Ноль внизу означает отсутствие электрического заряда.)
. Точные измерения показали, что масса нейтрона равна 1,0086649 а. е. м., т. е. чуть больше массы протона. Ноль внизу означает отсутствие электрического заряда.) -
Как называются протоны и нейтроны вместе? (нуклонами)
-
Что называется массовым числом и какой буквой оно обозначается? (Общее число нуклонов в ядре называется массовым числом и обозначается буквой А)
-
Что можно сказать о числовом значении массы атома (в а. е. м.) и его массовом числе? (массовое число А (т. е. общее число нуклонов в ядре) численно равно массе ядра m, выраженной в атомных единицах массы и округленной до целых чисел)
-
Как называется и какой буквой обозначается число протонов в ядре? (Число протонов в ядре называется зарядовым числом и обозначается буквой Z)
-
Где ставится зарядовое число по отношению к символу элемента? (зарядовое число ставится внизу перед буквенным обозначением элемента)
-
Что можно сказать о зарядовом числе, заряде ядра (выраженному в элементарных электрических зарядах) и порядковом номере в таблице Д. И. Менделеева для любого химического элемента? (зарядовое число (т. е. число протонов в ядре) численно равно заряду ядра, выраженному в элементарных электрических зарядах. Для каждого химического элемента зарядовое число равно атомному (порядковому) номеру в таблице Д. И. Менделева)
-
Как в общем виде принято обозначать ядро любого химического элемента? (Ядро любого химического элемента в общем виде обозначается так:
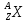 (под X подразумевается символ химического элемента))
(под X подразумевается символ химического элемента)) -
Какой буквой обозначают число нейтронов в ядре? (Число нейтронов в ядре обычно обозначают буквой N)
-
Какой формулой связаны между собой массовое число, зарядовое число и число нейтронов в ядре? (массовое число А представляет собой общее число протонов и нейтронов в ядре, то можно записать: А = Z + N)
III. Решение задач (слайд 4)
-
Ядром, какого элемента является протон? (водорода
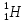 )
) -
Сколько нуклонов содержат ядра лития
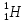 , меди
, меди 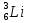 , серебра
, серебра 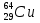 , свинца
, свинца 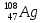 ? (3, 64, 108, 207)
? (3, 64, 108, 207) -
Определите нуклоновый состав ядер гелия
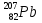 , кислорода
, кислорода 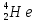 , селена
, селена 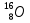 , ртути
, ртути 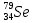 , радия
, радия 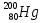 , урана
, урана 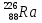 . (4=2+2, 16=8+8, 79=34+45, 200= 80+120, 226=88+138, 238=92+146)
. (4=2+2, 16=8+8, 79=34+45, 200= 80+120, 226=88+138, 238=92+146) -
Доля, каких нуклонов в ядрах элементов возрастает с увеличением зарядового числа? (нейтронов)
-
Назовите химический элемент, в атомном ядре которого содержатся нуклоны:
а)7р+7n; б)18р + 22n; в) 33р + 42n; г) 84р + 126n.
(азот N, аргон Ar, мышьяк As, полоний Po)
IV. Изучение нового материала
(слайд 5) На основе протонно-нейтронной модели строения атомных ядер было дано объяснение интересным экспериментальным фактам, открытым в первые два десятилетия XX в.
Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но различающихся, в частности, своей радиоактивностью.
В это время многие ученые занимались исследованием свойств радиоактивных элементов. В ходе этой работы проводились различные опыты, в том числе измерялись массы атомных ядер. (Вернее, измерялись массы ионов, но в данном случае массу ядра, иона и атома можно считать одинаковой, поскольку масса всех электронов в атоме пренебрежимо мала по сравнению с массой ядра.)
В зависимости от значений Z, A, N различают :
Изотопы
Изобары
Изотоны
Ядра с одинаковым Z,
но разными A
Ядра с одинаковыми A, но разными Z
Ядра с одинаковым числом нейтронов N
Более подробно рассмотрим изотопы. При исследовании свойств радиоактивных элементов обнаружилось, что у одного и того же химического элемента встречаются атомы с различными по массе ядрами. Так, например, было найдено несколько разновидностей атомов урана: с массами ядер, приблизительно равными 234 а. е. м., 235 а. е. м., 238 а. е. м. и 239 а. е. м. Причем все эти атомы обладали одинаковыми химическими свойствами. Они одинаковым образом вступали в химические реакции, образуя одни и те же соединения.
Наличие одних и тех же химических свойств означает, что все эти атомы имеют одинаковое число электронов в электронной оболочке, а значит, и одинаковые заряды ядер.
Если заряды ядер атомов одинаковы, значит, эти атомы действительно принадлежат одному и тому же химическому элементу (несмотря на различия в их массах) и имеют один и тот же порядковый номер в таблице Д. И. Менделеева, т. е. занимают в этой таблице одну и ту же клетку, одно и то же место. Отсюда и произошло название всех разновидностей одного химического элемента: изотопы (от греческих слов isos - одинаковый и topos - место).
Изотопы - это разновидности данного химического элемента, различающиеся по массе атомных ядер.
Благодаря созданию протонно-нейтронной модели ядра (т. е. примерно через два десятилетия после открытия изотопов), удалось объяснить, почему атомные ядра с одним и тем же зарядом обладают разными массами. Очевидно, ядра атомов изотопов содержат одинаковое число протонов, но различное число нейтронов.
В настоящее время установлено существование изотопов у всех химических элементов. Некоторые элементы имеют только нестабильные (т. е. радиоактивные) изотопы. Изотопы есть у самого тяжелого из существующих в природе элементов - урана (относительные атомные массы 238, 235 и др.) и у самого легкого - водорода (относительные атомные массы 1, 2, 3).
(слайд 6) Существует три изотопа водорода: 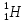 (протий),
(протий), 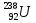 (дейтерий) и
(дейтерий) и 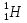 (тритий). Ядро изотопа
(тритий). Ядро изотопа 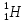 вообще не имеет нейтронов - оно представляет собой один протон. Соответственно его заряд равен элементарному электрическому заряду (цифра внизу), а масса приблизительно равна 1 а. е. м. (цифра вверху). В состав ядра дейтерия (
вообще не имеет нейтронов - оно представляет собой один протон. Соответственно его заряд равен элементарному электрическому заряду (цифра внизу), а масса приблизительно равна 1 а. е. м. (цифра вверху). В состав ядра дейтерия (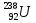 ) входят две частицы: протон и нейтрон. Поэтому масса дейтерия приблизительно равна 2 а. е. м. Ядро трития состоит из трех частиц: одного протона и двух нейтронов. Поэтому масса трития приблизительно равна 3 а. е. м.
) входят две частицы: протон и нейтрон. Поэтому масса дейтерия приблизительно равна 2 а. е. м. Ядро трития состоит из трех частиц: одного протона и двух нейтронов. Поэтому масса трития приблизительно равна 3 а. е. м.
Существование изотопов является причиной того, что относительные атомные массы большинства химических элементов в таблице Д. И. Менделеева выражены дробным числом. Поскольку химические элементы обычно состоят из смеси нескольких изотопов, то приходится указывать среднее значение массы ядер атомов всех изотопов данного элемента. А это среднее значение чаще всего оказывается дробным числом. Например, в среднем на 100 атомов хлора Сl приходится 75 атомов с массой 35 а. е. м. и 25 атомов с массой 37 а. е. м. (массы взяты с точностью до целых чисел). Среднее значение массы атома в данном случае вычисляется следующим образом:
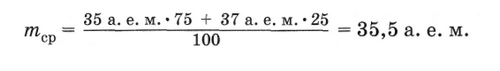
В атомной индустрии всевозрастающую ценность для человечества представляют радиоактивные изотопы.
(слайд 7) Радиоактивные изотопы получают в атомных реакторах и на ускорителях элементарных частиц.
Химические свойства радиоактивных изотопов не отличаются от свойств нерадиоактивных изотопов тех же элементов, но они являются источниками радиоактивного излучения.
Элементы, не существующие в природе. С помощью ядерных реакций можно получить радиоактивные изотопы всех химических элементов, встречающихся в природе только в стабильном состоянии. Элементы под номерами 43, 61, 85 и 87 вообще не имеют стабильных изотопов и впервые получены искусственно. Так, например, элемент с порядковым номером 43, названный технецием, имеет самый долгоживущий изотоп с периодом полураспада около миллиона лет.
С помощью ядерных реакций получены также трансурановые элементы. О нептунии и плутонии вы уже знаете. Кроме них, получены еще следующие элементы: америций (Z = 95), кюрий (Z = 96), берклий (Z = 97), калифорний (Z = 98), эйнштейний (Z = 99), фермий (Z = 100), менделевий (Z = 101), нобелий (Z = 102), лоуренсий (Z = 103), резерфордий (Z = 104), дубний (Z = 105), сиборгий (Z = 106), борий (Z = 107), хассий (Z = 108), мейтнерий (Z = 109), а также элементы под номерами 110, 111 и 112, не имеющие пока общепризнанных названий. Элементы, начиная с номера 104, впервые синтезированы либо в подмосковной Дубне, либо в Германии.
Меченые атомы. В настоящее время, как в науке, так и в производстве все более широко используются радиоактивные изотопы различных химических элементов. Наибольшее применение имеет метод меченых атомов.
Метод основан на том, что химические свойства радиоактивных изотопов не отличаются от свойств нерадиоактивных изотопов тех же элементов.
Обнаружить радиоактивные изотопы можно очень просто - по их излучению. Радиоактивность является своеобразной меткой, с помощью которой можно проследить за поведением элемента при различных химических реакциях и физических превращениях веществ. Метод меченых атомов стал одним из наиболее действенных методов при решении многочисленных проблем биологии, физиологии, медицины и т. д.
Радиоактивные изотопы - источники излучений. Радиоактивные изотопы широко применяются в науке, медицине и технике как компактные источники γ-лучей. Главным образом используется радиоактивный кобальт  .
.
(слайд 8) Радиоактивные изотопы в биологии и медицине. Одним из наиболее выдающихся исследований, проведенных с помощью меченых атомов, явилось исследование обмена веществ в организмах. Было доказано, что за сравнительно небольшое время организм подвергается почти полному обновлению. Слагающие его атомы заменяются новыми.
Лишь железо, как показали опыты по изотопному исследованию крови, является исключением из этого правила. Железо входит в состав гемоглобина красных кровяных шариков. При введении в пищу радиоактивных атомов железа было обнаружено, что они почти не поступают в кровь. Только в том случае, когда запасы железа в организме иссякают, железо начинает усваиваться организмом.
Если не существует достаточно долго живущих радиоактивных изотопов, как, например, у кислорода и азота, меняют изотопный состав стабильных элементов. Так, добавлением к кислороду избытка изотопа  было установлено, что свободный кислород, выделяющийся при фотосинтезе, первоначально входил в состав воды, а не углекислого газа.
было установлено, что свободный кислород, выделяющийся при фотосинтезе, первоначально входил в состав воды, а не углекислого газа.
Радиоактивные изотопы применяются в медицине, как для постановки диагноза, так и для терапевтических целей.
Радиоактивный натрий, вводимый в небольших количествах в кровь, используется для исследования кровообращения.
Йод интенсивно отлагается в щитовидной железе, особенно при базедовой болезни. Наблюдая с помощью счетчика за отложением радиоактивного йода, можно быстро поставить диагноз. Большие дозы радиоактивного йода вызывают частичное разрушение аномально развивающихся тканей, и поэтому радиоактивный йод используют для лечения базедовой болезни.
Интенсивное γ-излучение кобальта используется при лечении раковых заболеваний (кобальтовая пушка).
Радиоактивные изотопы в промышленности. Не менее обширна область применения радиоактивных изотопов в промышленности. Одним из примеров может служить способ контроля износа поршневых колец в двигателях внутреннего сгорания. Облучая поршневое кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным. При работе двигателя частички материала кольца попадают в смазочное масло. Исследуя уровень радиоактивности масла после определенного времени работы двигателя, определяют износ кольца.
Радиоактивные изотопы позволяют судить о диффузии металлов, процессах в доменных печах и т. д. Мощное γ-излучение радиоактивных препаратов используют для исследования внутренней структуры металлических отливок с целью обнаружения в них дефектов.
Радиоактивные изотопы в сельском хозяйстве. Все более широкое применение получают радиоактивные изотопы в сельском хозяйстве. Облучение семян растений (хлопчатника, капусты, редиса и др.) небольшими дозами γ-лучей от радиоактивных препаратов приводит к заметному повышению урожайности.
Большие дозы радиации вызывают мутации у растений и микроорганизмов, что в отдельных случаях приводит к появлению мутантов с новыми ценными свойствами (радиоселекция). Так выведены ценные сорта пшеницы, фасоли и других культур, а также получены высокопродуктивные микроорганизмы, применяемые в производстве антибиотиков. Гамма-излучение радиоактивных изотопов используется также для борьбы с вредными насекомыми и для консервации пищевых продуктов.
Широкое применение получили меченые атомы в агротехнике. Например, чтобы выяснить, какое из фосфорных удобрений лучше усваивается растением, помечают различные удобрения радиоактивным фосфором  . Исследуя затем растения на радиоактивность, можно определить количество усвоенного ими фосфора из разных сортов удобрения.
. Исследуя затем растения на радиоактивность, можно определить количество усвоенного ими фосфора из разных сортов удобрения.
Радиоактивные изотопы в археологии. Интересное применение для определения возраста древних предметов органического происхождения (дерева, древесного угля, тканей и т. д.) получил метод радиоактивного углерода. В растениях всегда имеется β-радиоактивный изотоп углерода 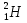 с периодом полураспада Т=5700 лет. Он образуется в атмосфере Земли в небольшом количестве из азота под действием нейтронов. Последние же возникают за счет ядерных реакций, вызванных быстрыми частицами, которые поступают в атмосферу из космоса (космические лучи).
с периодом полураспада Т=5700 лет. Он образуется в атмосфере Земли в небольшом количестве из азота под действием нейтронов. Последние же возникают за счет ядерных реакций, вызванных быстрыми частицами, которые поступают в атмосферу из космоса (космические лучи).
Соединяясь с кислородом, этот изотоп углерода образует углекислый газ, поглощаемый растениями, а через них и животными. Один грамм углерода из образцов молодого леса испускает около пятнадцати β-частиц в секунду.
После гибели организма пополнение его радиоактивным углеродом прекращается. Имеющееся же количество этого изотопа убывает за счет радиоактивности. Определяя процентное содержание радиоактивного углерода в органических остатках, можно определить их возраст, если он лежит в пределах от 1000 до 50 000 и даже до 100 000 лет. Таким методом узнают возраст египетских мумий, остатков доисторических костров и т. д.
V. Закрепление изученного материала
-
Что такое изотопы?
-
В чем состоит сходство ядер атомов изотопов?
-
Как с точки зрения протонно-нейтронной модели ядра объясняется существование ядер с одинаковыми зарядами и различными массами?
-
Расскажите об изотопах водорода.
-
Почему масса атомов большинства химических элементов в таблице Менделеева выражена дробным числом? Приведите пример.
VI.Домашнее задание