- Учителю
- Урок по физики для 10 класса 'Закон сохранения энергии в тепловых процессах. Применение первого закона термодинамики к изопроцессам'
Урок по физики для 10 класса 'Закон сохранения энергии в тепловых процессах. Применение первого закона термодинамики к изопроцессам'
Тема: «Закон сохранения энергии в тепловых процессах. Применение первого закона термодинамики к изопроцессам»
Цели и задачи урока:
Образовательная: Организовать деятельность учащихся по закреплению основных понятий термодинамики;
Развивающая: Создать условия для решения олимпиадных задач по теме;
Воспитательная: Содействовать развитию внимательности, инициативности, трудолюбия, творческих способностей;
Тип урока: урок применения знаний и умений;
Форма проведения урока: практикум.
Межпредметные связи: математика, химия
Ожидаемый результат:
-
владеть изученными на уроке терминами на казахском, русском и английском языках;
-
уметь применять полученные знания для решения олимпиадных задач;
Структура урока:
-
Организация начала урока
-
Актуализация опорных знаний
-
Объяснение нового материала
-
Закрепление новых знаний
-
Задание на дом
-
Подведение итогов урока.
-
Рефлексия
Ход урока:
-
Организация начала урока
Здравствуйте уважаемые участники нашего онлайн занятия. Вас приветствует город Астана, Назарбаев Интеллектуальная школа физико-математического направления на уроке физики в 10 классе. Прежде чем мы с вами начнем беседу, я хочу, чтобы вы сели поудобнее, отвлеклись от посторонних дел и погрузились в удивительный мир физики. Сегодня мы с вами продолжаем изучать тему: «Закон сохранения энергии в тепловых процессах. Применение первого закона термодинамики к изопроцессам». Цель нашего занятия - научиться решать олимпиадные задачи по данной теме.
Глоссарий к нашему уроку:
Термодинамика
Термодинамика
Thermodynamics
Система
Жүйе
System
Идеальный газ
Идеалды газ
Рerfect gas
Макроскопические параметры
Макроскопиялық параметрлер
Macroscopic parameters
Изопроцесс
Изопроцесс
Izoprotsess
Температура
Температура
Temperature
Давление
Қысым
Pressure
Объем
Көлем
Volume
Работа
Жұмыс
Work
-
Актуализация опорных знаний
Прежде чем мы приступим непосредственно к изучению темы нашего урока, давайте мы с вами вспомним то, что вы проходили раннее. Для этого вам необходимо взять ручку и листок бумаги для того, чтобы вы могли поставить себе баллы. За каждый правильный ответ вы ставите себе один балл. Давайте ответим на следующие вопросы.
-
На что расходуется количество теплоты, переданное системе, согласно первому закону термодинамики?
Ответ: На прошлом уроке мы с вами говорили о первом законе термодинамики. Первый закон термодинамики называют еще законом сохранения энергии для тепловых процессов. Он определяет количественное соотношение между изменением внутренней энергии 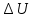 , количеством теплоты
, количеством теплоты 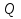 , подведенным к ней, и суммарной работой внешних сил
, подведенным к ней, и суммарной работой внешних сил 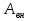 , действующих на систему.
, действующих на систему.
Первый закон термодинамики: изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работе внешних сил действующих на нее.
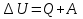
Количество теплоты, поглощаемое телом, считают положительным, а выделяемое - отрицательным.
Для изолированной системы, которая не обменивается теплотой с окружающими телами (те есть при 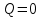 ) и над которой не совершается работа внешних сил (
) и над которой не совершается работа внешних сил (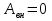 )
)
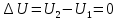
или
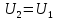
Или другими словами внутренняя энергия замкнутой изолированной системы сохраняется.
В термодинамике наибольший интерес представляет преобразование внутренней энергии в работу, совершаемую газом. Как было сказано раннее, эта работа отличается от работы внешних сил только знаком:
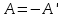 (1)
(1)
С учетом соотношения (1) первый закон термодинамики можно сформулировать и так:
Количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами
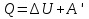
Количество теплоты, сообщаемое газу для изменения его состояния, зависит от способа перехода газа из одного состояния в другое. При разных процессах, связывающих два состояния тела, количество подведенной теплоты будет различным.
-
Сформулируйте первый закон термодинамики для изобарного процесса.
Ответ: Как вы помните, изобарный процесс - это процесс, проходящий при постоянном давлении. При данном процессе количество теплоты идет и на совершение работы газом и на изменение его внутренней энергии.
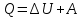
-
Какой процесс называется адиабатным? Сформулируйте первый закон термодинамики для адиабатного процесса.
Ответ: Как было сказано раннее, наибольший интерес представляет процесс преобразования внутренней энергии газа в работу. Поэтому, для наиболее эффективного преобразования внутренней энергии газа в совершаемую им работу следует предотваратить возможные потери внутренней энергии в результате теплопередачи окружающим телам. Поэтому систему теплоизолируют.
Теплоизолированная система - это система не обменивающаяся энергией с окружающими телами.
В теплоизолированной системе происходит так называемый адиабатный процесс.
Так как нет теплообмена с окружающей средой, следовательно
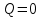
и первый закон термодинамики для адиабатного процесса будет иметь в следующий вид
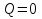
или
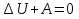
При адиабатном расширении 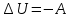 , следовательно
, следовательно 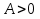 . Это означает, что газ совершает работу над внешними телами за счет уменьшения своей внутренней энергии.
. Это означает, что газ совершает работу над внешними телами за счет уменьшения своей внутренней энергии.
-
Почему при изобарном расширении газа от объема V1 до объема V2 требуется большее количество теплоты, чем при изотермическом процессе?
Ответ: Для изобарного расширения газа от объема 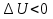 до объема
до объема 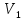 требуется большее количество теплоты, чем при изотермическом процессе, так как при изобарном процессе меняется температура газа, а при изотермическом не меняется.
требуется большее количество теплоты, чем при изотермическом процессе, так как при изобарном процессе меняется температура газа, а при изотермическом не меняется.
-
Почему при адиабатном расширении температура газа падает, а при сжатии возрастает?
Ответ: При адиабатном сжатии температура возрастает, так как над системой совершается работа, которая увеличивает внутреннюю энергию тела. А как вы помните, внутренняя энергия тела зависит от температуры, и при увеличении внутренней энергии тела, соответственно, увеличивается температура. Если же газ совершает работу, то изменение внутренней энергии отрицательно, так как газ совершает работу за счет уменьшения его внутренней энергии. Следовательно, температура газа будет понижаться.
Тест «Проверь себя!»
1. Чему равно изменение внутренней энергии одного моля идеального одноатомного газа, если Т1=Т, а Т2=2Т?
А.) RТ; Б.) 2RТ; В.) 3RТ; Г.) 1,5RТ.
2. Какую работу совершает газ, расширяясь изобарно при давлении 2 ∙ 105 Па от объёма V1=0,1 м3 до объёма V2=0,2 м3?
А.) 2 ∙ 106 Дж; Б.) 200 кДж; В.) 0,2 ∙ 105 Дж.
3. Термодинамической системе передано количество теплоты, равное 2000 Дж, и над ней совершена работа 500 Дж. Определите изменение его внутренней энергии этой системы.
А.) 2500 Дж; Б.) 1500 Дж; В.) ∆U=0.
4. В цилиндре под поршнем находится воздух, массой 29 кг. Какую работу совершит воздух при изобарном расширении, если температура его увеличилась на 100 К. Массу поршня не учитывать.
А.) 831 Дж; Б.) 8,31 кДж; В.) 0,83 МДж.
5. Какая физическая величина вычисляется по формуле 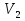 ?
?
А.) количество теплоты в идеальном газе;
Б.) давление идеального газа;
В.) внутренняя энергия одноатомного идеального газа;
Г.) внутренняя энергия одного моля идеального газа.
-
Объяснение нового материала
Закон сохранения энергии утверждает, что количество энергии остается неизменным при любых ее превращениях. Но данный закон не учитывает, какие энергетические превращения возможны. Между тем многие процессы, вполне допустимые с точки зрения закона сохранения энергии, никогда не протекают в действительности. Нагретые тела остывают, передавая свою энергию окружающим телам, обратный процесс передачи теплоты от холодного тела к горячему не противоречит закону сохранения энергии, но на самом деле не происходит. Число примеров можно привести неограниченное количество. Все примеры говорят о том, что процессы в природе имеют определенную направленность, никак не отраженную в первом законе термодинамики. Все процессы в природе текут в одном определенном направлении. В обратном направлении самопроизвольно они протекать не могут. Все процессы в природе необратимы, например - старение организмов, диффузия. Рассмотрим понятие обратимого процесса.
Обратимым называется процесс, который отвечает следующим условиям:
- его можно провести в двух противоположных направлениях;
- в каждом из этих случаев система и окружающие ее тела проходят через одни и те же промежуточные состояния;
- после проведения прямого и обратного процессов система и окружающие ее тела возвращаются к исходному состоянию.
Всякий процесс, не удовлетворяющий хотя бы одному из этих условий, является необратимым.
Реальные тепловые процессы также необратимы.
Примеры:
При диффузии выравнивание концентраций происходит самопроизвольно. Обратный же процесс сам по себе никогда не пойдет: никогда самопроизвольно смесь газов, например, не разделится на составляющие ее компоненты. Следовательно, диффузия - необратимый процесс.
Теплообмен, как показывает опыт, также является односторонне направленным процессом. В результате теплообмена энергия передается сама по себе всегда от тела с более высокой температурой к телу с более низкой температурой. Обратный процесс передачи теплоты от холодного тела к горячему сам по себе никогда не происходит.
Необратимым является также процесс превращения механической энергии во внутреннюю при неупругом ударе или при трении.
Между тем из первого закона термодинамики направленность и тем самым необратимость тепловых процессов не вытекает. Первый закон термодинамики требует лишь, чтобы количество теплоты, отданное одним телом, в точности равнялось количеству теплоты, которое получит другое. А вот вопрос о том, от какого тела, от горячего к холодному или наоборот, перейдет энергия, остается открытым.
Направленность реальных тепловых процессов определяется вторым законом термодинамики, который был установлен непосредственным обобщением опытных фактов. Это постулат. Немецкий ученый Р. Клаузиус дал такую формулировку второго закона термодинамики: невозможно перевести тепло от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах.
КЛАУЗИУС Рудольф Юлиус Эмануэль (1822-1888), немецкий физик-теоретик, один из создателей термодинамики и молекулярно-кинетической теории теплоты. Работы Клаузиуса относятся к области молекулярной физики, термодинамики, теории паровых машин, теоретической механики, математической физики. Он первым проанализировал идеи С.Карно и, развивая их, сформулировал принцип эквивалентности теплоты и работы. В 1850 независимо от У.Ранкина получил соотношение между теплотой и работой (первое начало термодинамики) и разработал идеальный термодинамический цикл паровой машины (цикл Ранкина - Клаузиуса). В том же году (одновременно с У.Томсоном) дал первую формулировку второго начала термодинамики: "Теплота не может сама собою перейти от более холодного тела к более теплому". В 1865 ввел понятие энтропии, установил ее важнейшее свойство. Клаузиус внес большой вклад в развитие молекулярно-кинетической теории теплоты. Его работы способствовали введению в физику статистических методов, благодаря чему удалось с единых позиций объяснить такие разные явления в газах, как внутреннее трение, теплопроводность, диффузия.
Никола Леонар Сади Карно французский физик и военный инженер, один из основателей термодинамики. Сади Карно скоропостижно скончался в возрасте всего 36 лет от холеры. Карно интересовался многими новыми промышленно-технологическими разработками того времени. Занявшись теоретическим обоснованием принципов работы паровых машин, Карно стал одним из пионеров термодинамики, предложив свою знаменитую модель идеального двигателя. Свои идеи Сади Карно опубликовал в 1824 г. в форме фундаментального трактата «Размышления о движущей силе огня и о машинах, способных развивать эту силу». В нём Карно рассмотрел в общем виде вопрос о "получении движения из тепла". Анализируя идеальный круговой процесс (известный сейчас как цикл Карно), он впервые пришёл к выводу о том, что полезная работа производится только при переходе тепла от нагретого тела к более холодному. Карно высказал также положение, что величина работы обусловлена разностью температур нагревателя и холодильника и не зависит от природы вещества, работающего в тепловой машине (теорема Карно). В своих рассуждениях Карно придерживался теории теплорода, однако в дальнейшем, как явствует из его записок, изданных посмертно, он от неё отказался
Уильям Томсон
В круг научных интересов Томсона входили термодинамика, гидродинамика, электромагнетизм, теория упругости, теплота, математика, техника. В 1851 г. У. Томсон сформулировал (независимо от Р. Клаузиуса) 2-е начало термодинамики. В его работе «О динамической теории теплоты» излагалась новая точка зрения на теплоту, согласно которой «теплота представляет собой не вещество, а динамическую форму механического эффекта». Поэтому «должна существовать некоторая эквивалентность между механической работой и теплотой». Томсон указывает, что этот принцип, «по-видимому, впервые... был открыто провозглашен в работе Ю. Майера «Замечания о силах неживой природы». Далее он упоминает работу Дж. Джоуля, исследовавшего численное соотношение, «связывающее теплоту и механическую силу».
Томсон утверждает, что вся теория движущей силы теплоты основана на двух положениях, из которых первое восходит к Джоулю и формулируется следующим образом: «Во всех случаях, когда равные количества механической работы получаются каким бы то ни было способом исключительно за счёт теплоты или бывают израсходованы исключительно на получение тепловых действий, всегда теряются или приобретаются равные количества теплоты».
Итак, из второго закона термодинамики вытекает невозможность создания вечного двигателя второго рода, т.е. двигателя, который бы совершал работу за счет охлаждения какого-либо одного тела.
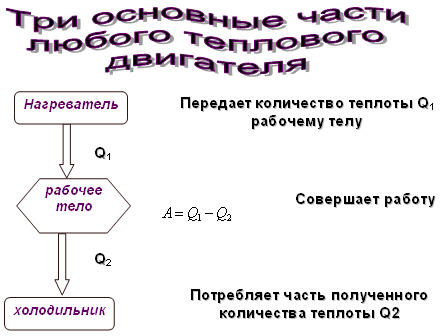
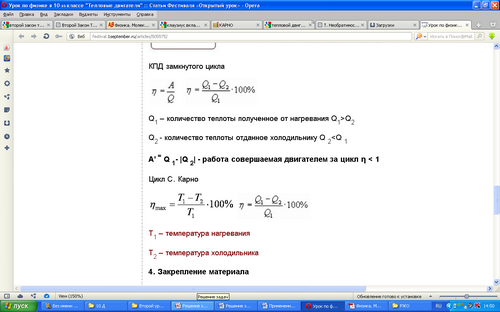
Тепловой двигатель.
Развитие техники зависит от умения использовать громадные запасы внутренней энергии. Использовать эту энергию- это значит совершать за счет ее полезную работу. Рассмотрим источники, которые совершают работу за счет внутренней энергии.
Тепловой двигатель - устройство, превращающее внутреннею энергию топлива в механическую. Рассмотрим устройство и принцип работы теплового двигателя. Работа любого теплового двигателя циклична.
Каждый цикл состоит из разных процессов:
- получение энергии от нагревателя;
- рабочего хода;
- передача неиспользуемой части энергии холодильнику.
Наличие нагревателя, рабочего тела, холодильника - принципиально
необходимое условие для непрерывной циклической работы любого теплового двигателя.
Задача 1
Над одним молем идеального одноатомного газа совершают процесс 1-2-3-4-1 (см.рис.), причем газ получает от нагревателя за один цикл количество теплоты Q. Какое количество теплоты будет порлучать за один цикл газ, если совершать над ним процесс 2-3-4-А-В-С-2? Известно, что Т3=16Т1, Т2=Т4, В - точка пересечения изотермы Т= Т2 с прямой 1-3, проходящей через начало координат pV - диаграммы. Ответ выразить через Q.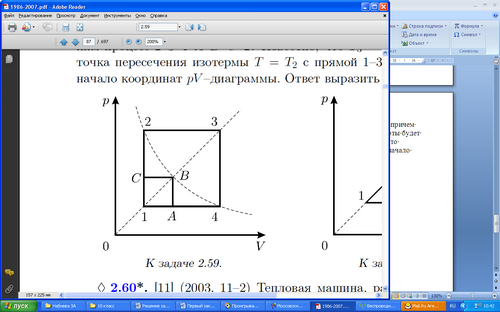
Решение:
Рассмотрим сначала исходный цикл и выразим сообщаемое газу количество теплоты через другие параметры системы. Из первого начала термодинамики (∆Q = ∆U + ∆A) следует, что теплота сообщается газу на участках 1-2 и 2-3. Значит, количество теплоты, сообщённое газу за один цикл:
1-2 процесс изохорный, следовательно, все количество теплоты, полученное в данном процессе, идет на увеличение внутренней энергии
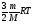
2-3 процесс изобарный, следовательно, количество теплоты, полученное в данном процессе, идет и на увеличение внутренней энергии и на совершение работы газом:
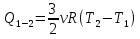
А по уравнению М-К
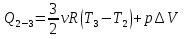
Тогда
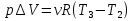
И полное количество теплоты во все процессе 1-2-3-4-1 равно:
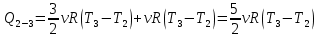
Выразим температуру Т2 через Т1. Для этого рассмотрим участки 1-2 и 2-4
1-2 процесс изохорный, следовательно
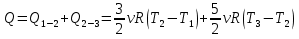
3-4 тоже процесс изохорный, следовательно:
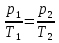
Причем р2=р3, р1=р4 , Т2=Т4
Тогда получаем
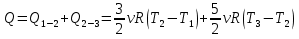
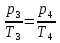
И
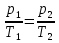
Отсюда Т2
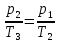
По условию задачи Т3=16Т1, находим, что Т2=4Т1 . Теперь количество теплоты Q также можно выразить через Т1
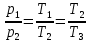
Рассмотрим далее цикл 2-3-4-А-В-С-2. Теплота Q1 сообщается газу на участках С-2, 2-3 и А-В. Очевидно, что
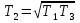
Где 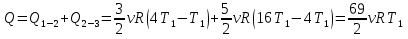 , а
, а 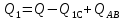 . Для того, чтобы сравнить Q1 и Q, выразим ТА, ТВ, и ТС через Т1. По аналогии ЧС циклом 1-2-3-4 и с учетом того, что ТВ = Т2 = 4Т1 можно утверждать, что в цикле 1-С-В-А-1
. Для того, чтобы сравнить Q1 и Q, выразим ТА, ТВ, и ТС через Т1. По аналогии ЧС циклом 1-2-3-4 и с учетом того, что ТВ = Т2 = 4Т1 можно утверждать, что в цикле 1-С-В-А-1
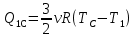
Подставив найденные значения температур в выражение для Q1,получим:
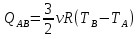
Учитывая, что 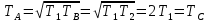 , приходим к окончательному ответу
, приходим к окончательному ответу 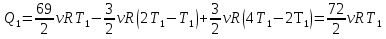
Рефлексия.
Для того, чтобы понять, продуктивен ли был урок для вас, вы можете ответить на вопросы, которые вы видите на экране.... Если большая часть ответов положительная, то значит наш урок прошел продуктивно, и на следующем уроке я жду вас в это же время для решения задач.
Подведение итогов урока.
Мы с вами сегодня изучили решали совместно задачи на первый закон термодинамики, а также освоили понятие теплового двигателя, разобрали второй закон термодинамики и понятие необратимости процессов. В начале урока вы ставили себе балл за каждый правильный ответ.
Если Вы получили сумму баллов «6» или меньше не отчаивайтесь, почитайте учебник, например Мякишев Г.Я., Синяков А.З. том «Молекулярная физика и термодинамика» стр. 158-161.
Домашнее задание
Для закрепления знаний вам необходимо выполнить следующие задания:
Задача 1
В вертикальном цилиндре под тяжелым поршнем находится кислород массы m=2 кг. Для повышения температуры кислорода на ∆Т=5 К ему было сообщено количество теплоты Q=9160 Дж. Найти удельную теплоемкость кислорода с, работу А, совершаемую им при расширении, и увеличение его внутренней энергии ∆U. Молярная масса кислорода М=0,032 кг/моль.
Задача 2.
Два одинаковых сосуда соединены трубкой, объемом которой можно пренебречь. Система наполнена газом и находится при температуре 300 К. Когда один из сосудов был нагрет, а другой оставлен при прежней температуре, давление в системе увеличилось в 1,5 раза. На сколько градусов был нагрет один из сосудов?
Задача 3.
Баллон емкостью 40 л содержит сжатый воздух под давлением 18 МПа при 270 С. Какой объем (в литрах) воды можно вытеснить из цистерны подводной лодки воздухом этого баллона, если лодка находится на глубине 20 м, где температура 70С? Атмосферное давление 0,1 МПа, g=10 м/с2.