- Учителю
- Разработка урока - зачета по химии 11 класс по теме:
Разработка урока - зачета по химии 11 класс по теме:
Трехуровневый зачет вертушка 11 класс
Тема: «НЕМЕТАЛЛЫ»
Форма урока: зачет
Цель: проверить усвоение знаний учащихся по теме: «Неметаллы»; обобщить знания об общих свойствах неметаллов и их соединений; продолжить формировать навыки применения знаний в нестандартных и жизненных ситуациях, с использованием индивидуальных и дифференцированных заданий.
Задачи:
1. Проверить обобщить и закрепить знания учащихся о неметаллах и их соединениях; способствовать развитию умения мыслить логически и владеть химическим языком; переходу от формального - логического восприятия материала данной темы к образно-логическому мышлению с использованием разноуровневых, посильных и нестандартных задач.
2. Развить навыки наблюдения, выявления ошибок, решения задач, умения выделять главное, сравнивать изучаемые факты, логично излагать мысли и делать выводы; учить размышлять, делать предположения, прогнозировать.
3. Содействовать формированию основных мировоззренческих идей через познавательную активность и творческую самостоятельность учащихся.
4. Воспитывать умения работать самостоятельно с применением само- и взаимоконтроля. Показать связь изучаемой темы с жизнью. Воспитывать научное мировоззрение на основе взаимосвязи свойств и строения.
Оборудование и реактивы: пробирки, спиртовки, пробиркодержатели, спички и растворы:![]() ;
;![]() ;
;![]() ;
;![]()
![]()
![]()
![]()
![]() .
.
Подготовка к зачету.
Учитель готовит задания трех уровней сложности следующих видов: тест, теоретический вопрос, качественные и расчетные задачи, задание на превращение веществ.
Учитель готовит учеников, проверяющих задания.
За 1 - 2 недели в кабинете вывешивается информационный лист к зачету.
Каждому ученику выдается маршрутный лист. Очередность работы на этапах указывается в маршрутных листах.
МАРШРУТНЫЙ ЛИСТ.
Ф.И. ученика
Название этапа
Очередность этапов
уровень
№ задания
Оценка
Подпись проверяющего
Тест
Теория
Расчетная задача
Распознавание
Превращение
Ход урока.
Учащиеся входят в класс с маршрутными листами, 5 чистыми листами, ручкой и идут на этап, обозначенный под № 1. Ученики выбирают задания по уровням сложности и отвечают на него письменно или устно, на этапе «распознавание веществ» выполняют эксперимент.
На работу на каждом этапе отводится 7 - 8 минут, проверяющий выставляет в маршрутный лист уровень, № задания, баллы за выполненное задание.
Оценка выставляется как среднее арифметическое всех этапов.
ПРИЛОЖЕНИЕ
«Распознавание веществ»
1 уровень
1. Докажите наличие иона ![]()
2. Докажите наличие иона ![]()
3. Докажите наличие иона ![]()
4. Докажите наличие иона ![]()
5. Докажите наличие иона ![]()
2 уровень
1. Распознайте растворы с помощью одного реактива:![]()
2. Распознайте растворы с помощью одного реактива:![]()
3. Распознайте растворы с помощью одного реактива:![]()
4. Распознайте растворы с помощью одного реактива:![]() ;
;![]()
5. Распознайте растворы с помощью одного реактива:![]()
3 уровень
1. Распознать без дополнительных реактивов растворы:
![]()
2. Распознать без дополнительных реактивов растворы:
![]()
3. Распознать без дополнительных реактивов растворы:
![]()
4. Распознать без дополнительных реактивов растворы:
![]()
5. Распознать без дополнительных реактивов растворы:![]()
Этап « Превращение веществ»
1 уровень
1. Закончить уравнения реакций
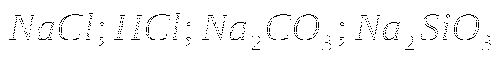
2.Закончите уравнение реакций
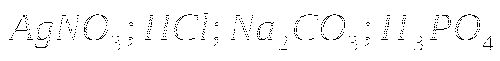
3.Закончите уравнения реакций
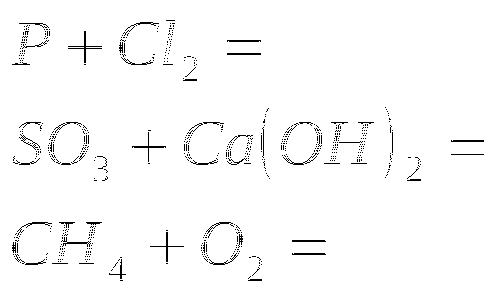
4. Закончите уравнения реакций
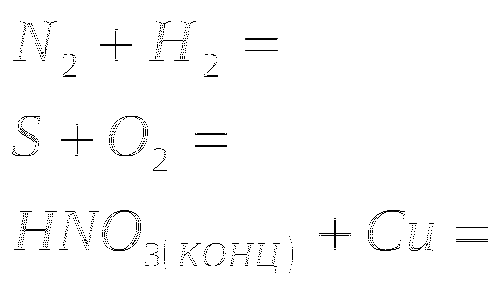
5. Закончите уравнения реакций
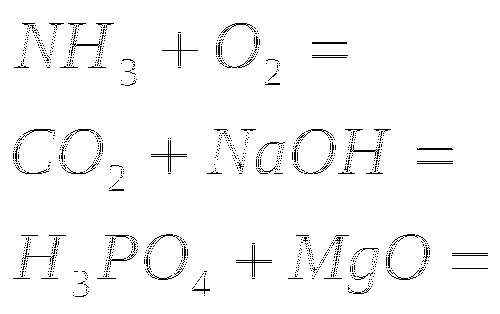
2 уровень
Осуществите превращения:
1.![]()
2.![]()
3.![]()
4.![]()
5.![]()
3 уровень
Осуществите превращения:
1.![]()
2.![]()
3.![]()
4.![]()
5.![]()
Этап «Тест»
Вариант 1
-
Атомные кристаллические решетки имеют простые вещества, образованные:
а) О, б) S, в) Cl, г) C, д) Si.
2. Газами при нормальных условиях являются:
а) ![]() , б) C, в)
, б) C, в) ![]() , г)
, г) ![]() , д)
, д)![]() .
.
3. Аллотропные модификации образуют следующие элементы:
а) ![]() , б)
, б) ![]() , в)
, в) ![]() , г)
, г) ![]() , д)
, д) ![]() .
.
4. Электронная формула элемента![]() . Его летучее водородное соединение:
. Его летучее водородное соединение:
а) ![]() , б)
, б) ![]() , в)
, в)![]() , г)
, г) ![]() .
.
5.Сила галогеноводородных кислот возрастает в ряду:
а)![]()
б)![]()
в)![]()
г)![]()
6. Из галогенов впервые в боевых действиях было применено вещество:
а) фтор, б) хлор, в) йод, г) бром.
7. Разбавленная серная кислота проявляет окислительные свойства за счёт атомов:
а)![]() , б)
, б)![]() , в)
, в)![]() .
.
8.Оксид азота V может взаимодействовать:
а) ![]() , б)
, б) ![]() , в)
, в)![]() , г)
, г)![]() , д)
, д)![]() .
.
9. Реакция:![]() доказывает следующие свойства аммиака:
доказывает следующие свойства аммиака:
а) окислительные, б)восстановительные, в)кислотные, г)основные.
10. Сила кислот в ряду![]()
а) уменьшается, б) увеличивается, в) сначала увеличивается, потом уменьшается, г) сначала падает, потом возрастает, д) не изменяется.
Вариант 2
-
Атомные кристаллические решетки имеют простые вещества, образованные:
а)![]() , б)
, б)![]() , в)
, в)![]() , г)
, г)![]() , д)
, д)![]() .
.
2. Газами при нормальных условиях являются:
а) ![]() , б)
, б) ![]() , в)
, в) ![]() , г)
, г) ![]() , д)
, д) ![]() .
.
3. Аллотропные модификации образуют следующие элементы:
а)![]() , б)
, б) ![]() , в)
, в)![]() , г)
, г)![]() , д)
, д)![]() ,
,
4. Электронная формула элемента![]() . Его летучее водородное соединение:
. Его летучее водородное соединение:
а)![]() , б)
, б) ![]() , в)
, в)![]() , г)
, г)![]() , д)
, д)![]() .
.
5. Основные свойства летучих водородных соединений убывает в ряду:
а)![]()
б)![]()
в)![]()
г)![]()
6. Для поглощения хлора можно использовать концентрированные растворы:
а) ![]() , б)
, б) ![]() , в)
, в) ![]() , г)
, г)![]() .
.
7. Концентрированная серная кислота проявляет окислительные свойства за счёт атомов:
а)![]() , б)
, б)![]() , в)
, в) ![]() .
.
8. Оксид азота 6 может взаимодействовать:
а) ![]() , б)
, б) ![]() , в)
, в)![]() , г)
, г)![]() , д)
, д)![]() ,
,
9. Реакция:![]() доказывает следующие свойства сероводорода:
доказывает следующие свойства сероводорода:
а) окислительные, б) восстановительные, в) кислотные, г) основные.
10. Сила кислот в ряду![]()
а) уменьшается, б) увеличивается , в) сначала увеличивается, потом уменьшается, г) сначала падает, потом возрастает, д) не изменяется.
ПРИМЕЧАНИЕ:9-10 правильных ответов-«5»; 7-8-«4»; 5-6-«3»; менее 5-«2»
Этап «Теория»
I уровень (на «3»)
-
Напишите уравнения реакций, характеризующие свойства разбавленной серной кислоты.
-
Напишите уравнения реакций, характеризующие свойства оксида серы (VI).
-
Напишите уравнения реакций, характеризующие свойства содяной кислоты.
-
Напишите уравнения реакций, характеризующие свойства оксида фосфора (V).
-
Напишите уравнения реакций, характеризующие свойства аммиака.
II уровень (на «4»)
-
Запишите формулы летучих водородных соединений неметаллов II периода. Объясните, как и почему изменяются их кислотные свойства.
-
Запишите формулы высших оксидов неметаллов III периода. Объясните, как и почему изменяются их кислотные свойства.
-
Запишите формулы высших кислот элементов III периода. Объясните, как и почему изменяются их кислотные свойства.
-
Запишите формулы летучих водородных соединений неметаллов VIА подгруппы. Объясните, как и почему изменяются их кислотные свойства.
-
Запишите формулы высших кислот элементов VA подгруппы. Объясните, как и почему изменяются их кислотные свойства.
III уровень (на «5»)
-
Сравните окислительные и кислотные свойства серной и азотной кислот. Ответ подтвердите уравнениями реакций.
-
Сравните окислительно-восстановительные и кислотные свойства оксида серы (IV) и оксида углерода (IV). Ответ подтвердите уравнениями реакций.
-
Сравните окислительные и кислотные свойства воды и фтороводорода. Ответ подтвердите уравнениями реакций.
-
Сравните окислительные и кислотные свойства концентрированной и разбавленной азотной кислоты. Ответ подтвердите уравнениями реакций.
-
Сравните окислительные и кислотные свойства оксида углерода (II) и оксида углерода (IV). Ответ подтвердите уравнениями реакций.
Этап «Расчётная задача»
I уровень (на «3»)
-
В уравнении реакции Fe
 O
O + H
+ H = Fe + H
= Fe + H O поставьте коэффициенты и рассчитайте объём водорода (л), необходимый для восстановления 28г железа.
O поставьте коэффициенты и рассчитайте объём водорода (л), необходимый для восстановления 28г железа. -
В уравнении реакции CO + O
 = CO
= CO поставьте коэффициенты и рассчитайте объём кислорода (л), необходимый для получения 2 л углекислого газа.
поставьте коэффициенты и рассчитайте объём кислорода (л), необходимый для получения 2 л углекислого газа. -
В уравнении реакции P + O
 = P
= P O
O поставьте коэффициенты и рассчитайте объём кислорода (л), необходимый для сгорания 3,1 г фосфора.
поставьте коэффициенты и рассчитайте объём кислорода (л), необходимый для сгорания 3,1 г фосфора. -
В уравнении реакции CH
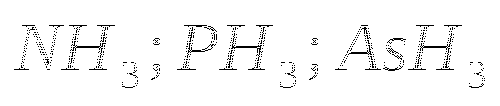 + O
+ O = CO
= CO + H
+ H O поставьте коэффициенты и рассчитайте объём углекислого газа (л), который получится при сжигании 3,2 г метана.
O поставьте коэффициенты и рассчитайте объём углекислого газа (л), который получится при сжигании 3,2 г метана. -
В уравнении реакции 2NH
 +Li = LiN H
+Li = LiN H + H
+ H поставьте коэффициенты и рассчитайте объём аммиака (л), необходимый для получения 2 л водорода.
поставьте коэффициенты и рассчитайте объём аммиака (л), необходимый для получения 2 л водорода.
II уровень (на «4»)
-
При взаимодействии 37г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака в %.
-
При сжигании в кислороде 62 г фосфора было получено 130 г оксида фосфора (V). Вычислите массовую долю выхода оксида фосфора (V) в %.
-
Сколько граммов 10% раствора гидроксида натрия понадобится для нейтрализации 8,96 л хлороводорода?
-
Сколько литров углекислого газа можно получить разложением 10 кг известняка, содержащего 20% примесей.
-
Сколько граммов осадка образуется при пропускании 11,2 л углекислого газа через 900 г 10% раствора гидроксида бария?
III уровень (на «5»)
-
Какой объём 80%-ной азотной кислоты (пл. 1,46 г/мл) необходим для «растворения» 32 г меди?
-
Какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 4 л (н.у.) оксида азота (IV), если объёмная доля его выхода составляет 96%?
-
При «растворении» в концентрированной серной кислоте 20 г сплава золота с медью выделилось 4,2 л (н.у.) оксида серы (IV). Определите массовую долю в % меди в этом сплаве.
-
Смесь газов хлора и водорода объёмом 1 л пропустили через раствор иодида калия. При этом выделилось 5,08 г йода. Определите объёмную долю (в %) газа хлора в исходной смеси.
-
Смесь кремния и угля массой 10 г обработали избытком концентрированного раствора гидроксида натрия. В результате реакции выделилось 5,6 л водорода (н.у). Определите массовую долю кремния (в %) в данной смеси.