- Учителю
- Урок на тему Ацетилен
Урок на тему Ацетилен
Открытый урок по химии на тему «Ацетилен»
Цели урока:
-
Образовательная:закрепить понятие непредельные углеводороды; изучить свойства и применение ацетилена;
-
Развивающая:научить пользоваться приемами сравнения, обобщения, делать выводы, расширять познавательные интересы.
-
Воспитывающая: воспитывать интерес к предмету химия.
Оборудование: мультимедийный проектор, компьютер. Урок сопровождается презентацией, электронное пособие «Виртуальная лаборатория. Химия 8-11 класс», интернет ресурсы.
Тип урока: комбинированный.
Форма занятия: урок изучения нового материала с использованием ИКТ.
ХОД УРОКА
I. Организационный момент
II. Изложение нового материала
Загадка
- Горит с образованием углекислого газа и воды, но не алкан;
- Обесцвечивает бромную воду, но не алкан;
- Подчиняется общей формуле СnH2n-2 , но не
алкадиен.
Подсказка - содержит 2 атома углерода.(Слайд 2)
1. Алкины - это алифатические (ациклические), непредельные
(ненасыщенные) углеводороды, с одной тройной углерод-углеродной
связью
С ≡ С в цепи и общей формулой СnH2n-2
2. Строение
Ацетилен - первый член гомологического ряда ацетиленовых
углеводородов, или алкинов.
Молекулярная формула ацетилена
C2H2
Структурная формула ацетилена H-C≡C-H
Электронная формула H : С : : : С
: Н
Углеродные атомы ацетилена, связанные тройной связью, находятся
в состоянии sp-гибридизации. При образовании молекулы ацетилена у
каждого атома С гибридизуются по одной s- и p-орбитали. В
результате этого каждый атом С приобретает по две гибридных
орбитали, а две p-орбитали остаются негибридными. Две гибридных
орбитали взаимно перекрываются, и между атомами С образуется
σ-связь. Остальные две гибридных орбитали перекрываются с
s-орбиталями атомов H, и между ними и атомами С тоже образуются
σ-связи. Четыре негибридных p-орбитали размещены взаимно
перпендикулярно и перпендикулярно направлениям σ-связей. В этих
плоскостях p-орбитали взаимно перекрываются, и образуются две
π-связи, которые относительно непрочные и в химических реакциях
легко разрываются.
Таким образом, в молекуле ацетилена имеются три σ-связи (одна связь
C-C и две связи C-H) и две π-связи между двумя С атомами. Тройная
связь в алкинах - не утроенная простая, а комбинированная,
состоящая из трех связей: одной σ- и двух π-связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи
вызывает дальнейшее сближение атомов С: расстояние между их
центрами составляет 0,120 нм.

sp-гибридные орбитали двух атомов углерода в
состоянии,
предшествующем образованию тройной связи и связей C-H
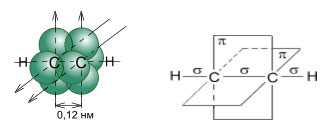
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p-связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях) (Слайды 4,5)
3. Физические свойства
С2Н2 - Ацетилен - бесцветный газ, легче
воздуха, мало растворим в воде, в чистом виде почти без запаха.
Свойства гомологов изменяются аналогично алкенам. По физическим
свойствам алкины напоминают алкены и алканы. Температуры их
плавления и кипения увеличиваются с ростом молекулярной массы. В
обычных условиях алкины С2-С3 - газы,
С4-С16 - жидкости, высшие алкины - твердые
вещества. Наличие тройной связи в цепи приводит к повышению
температуры кипения, плотности и растворимости их в воде по
сравнению с олефинами и парафинами. (Слайд 6)
4. Химические свойства алкинов
1. Реакции присоединения
1) Галогенирование - стадийно, до производных алканов:
(как и алкены обесцвечивают бромную воду</<font face="Times
New Roman, serif">!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан)
2) Гидратация - (реакция М.Г. Кучерова)
CH≡CH + H2O Hg2+,H+→ [CH2=CH-OH] → CH3-CH=O
протекает в присутствии солей ртути(II) - HgSO4, Hg(NO3)2 - с образованием уксусного альдегида:
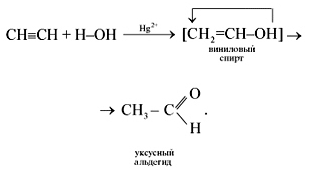
Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
3) Полимеризация
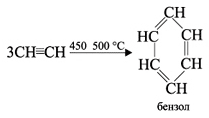
В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
При пропускании ацетилена над активированным углем при 450-500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Реакции окисления и восстановления
1) Горение - пламя сильно коптящее
СnH2n-2 + (3n-1)/2O2 t → nCO2 + (n-1)H2O + Q
R-C≡C-H + [Cu(NH3)2]Cl → R-C≡C-Cu↓ + NH4Cl +NH3
Ацетилениды серебра и меди (I) - разлагаются соляной кислотой:
R-C≡C-Cu↓ + HCl → R-C≡C-H + CuCl
Ацетилениды металлов - взрывчатые вещества!
3. Применение ацетилена (Слайд 7)
III. Закрепление материала: (Слайд 9)
- К каким углеводородам относятся алкины?
- Какая особенность в строении алкинов?
- Как получить газ ацетилен?
- Где применяют ацетилен?
IV. Подведение итогов. Выставление оценок.
V. Домашнее задание. Учебник О.С.Габриелян «Химия 10 класс», конспект.